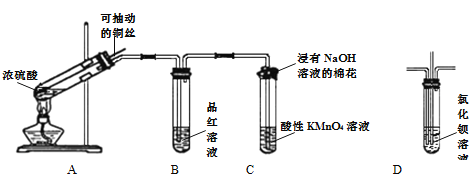
【题目】常温下,某化学小组探究硝酸银溶液的性质。
装置 | 实验序号 | 实验操作 | 实验现象 |
| 实验I | 向试管中滴加2%氨水并不断振荡 | 产生棕褐色沉淀,继续滴加沉淀消失 |
实验II | 1.向试管中加入0.1mol·L-lNaOH溶液1mL 2.继续滴加3%H2O2至过量 | 1.产生棕褐色沉淀 2.产生大量无色无味气体,有黑色沉淀生成 | |
实验III | 1.向试管中滴加1mL0.1molL-1KI溶液 2.取少量上层清液于试管甲中,加入淀粉溶液 | 1.产生黄色沉淀 2.溶液无明显变化 |
已知:AgOH是一种白色固体,常温下极不稳定,易分解为棕褐色难溶于水的氧化银固体
(1)常温下,0.1mo1L-1AgNO3溶液pH约为4,请用离子方程式解释原因___。
(2)实验I中,反应的化学方程式是___。
(3)实验II中,经检验,黑色沉淀的成分为Ag。有Ag产生的化学方程式是___。经测定,实验产生的气体体积远远大于该反应的理论值,可能的原因是___。
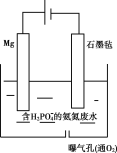
(4)实验中,产生黄色沉淀的离子方程式是___。有同学猜想,I-有还原性,Ag+有氧化性,AgNO3溶液与KI溶液应该可以发生氧化还原反应。他设计了如图原电池,做实验IV证明了猜想成立。其中,在A烧杯中,石墨电极表面变亮,经检测这种光亮的物质为银单质。乙溶液是___,检验B烧杯中产物的操作及现象是___,该氧化还原反应的离子方程式是__。

(5)对比实验III和实验IV,实验III无I2生成的可能原因是___(写出两条)。