题目内容
【题目】近年来,镁在汽车、航空、航天、机械制造、军事等产业中应用迅猛发展。
(1)写出工业上冶炼金属镁的化学方程式______________________________________。
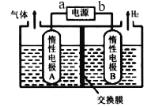
(2)某研究性小组探究以镁条、铝片为电极,稀氢氧化钠溶液为电解质溶液构成的原电池(如图所示),刚开始时发现电表指针向左偏转,镁条作负极;但随后很快指针向右偏转。
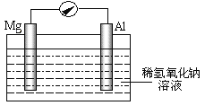
①开始阶段,镁条发生的电极反应式为_________,指出其反应类型为_________(填“氧化”或“还原”)。
②随后阶段,铝片发生的电极反应式为_________。
【答案】MgCl2 ![]() Mg+Cl2↑ Mg+ 2OH--2e-=Mg(OH)2 氧化 Al+ 4OH--3e-= AlO2-+2H2O
Mg+Cl2↑ Mg+ 2OH--2e-=Mg(OH)2 氧化 Al+ 4OH--3e-= AlO2-+2H2O
【解析】
(1)工业上通常用电解熔融的氯化镁的方式冶炼金属镁;
(2)①开始时发现电表指针向左偏转,镁条作负极,失电子,被氧化,发生氧化反应,生成镁离子与溶液中的氢氧根离子反应生成氢氧化镁;
②随后很快指针向右偏转,则Al作负极,失电子生成的铝离子反应生成偏铝酸根离子和水。
(1)工业上通常用电解熔融的氯化镁的方式冶炼金属镁,其方程式为MgCl2 ![]() Mg+Cl2↑;
Mg+Cl2↑;
(2)①开始时发现电表指针向左偏转,镁条作负极,失电子,被氧化,发生氧化反应,生成镁离子与溶液中的氢氧根离子反应生成氢氧化镁,则电极反应式为Mg+ 2OH--2e-=Mg(OH)2;
②随后很快指针向右偏转,则Al作负极,失电子生成的铝离子反应生成偏铝酸根离子和水,电极反应式为Al+ 4OH--3e-= AlO2-+2H2O。

练习册系列答案
相关题目