题目内容
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )
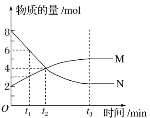
A. 化学方程式:2M![]() N
N
B. t2时,正逆反应速率相等,达到平衡
C. t3时,正反应速率大于逆反应速率
D. t1时,N的浓度是M浓度的2倍
【答案】D
【解析】
A.由图像可知N为反应物,M为生成物,然后找出在相同时间段内变化的M、N的物质的量之比(与是否达平衡无关)以确定M、N在化学方程式中的化学计量数之比,即该反应的化学方程式是:2N![]() M;A项错误;
M;A项错误;
B.t2时刻M、N的物质的量相等,但此时M、N的物质的量仍在发生变化,反应未达到平衡状态,因此正反应速率不等于逆反应速度,反应未到达平衡状态,B项错误;
C.t3时刻及t3时刻之后,M、N的物质的量不再改变,证明已达平衡状态,此时正、逆反应速率相等。C项错误;
D.t1时刻,N的物质的量为6mol,M的物质的量为3mol,在相同的体积下,N的浓度为M浓度的2倍,D项正确;
本题答案选D。

练习册系列答案
相关题目