题目内容
【题目】一些行业的废水中氨氮含量严重超标,废水脱氮已成为主要污染物减排和水体富营养化防治的研究热点,有多种方法可以去除。
I.电镀行业废水处理流程如图:
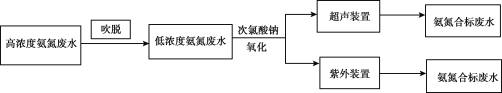
(1)吹脱法除氨氮:水中的氨氮大多数以NH4+和游离态的NH3保持平衡状态而存在。将空气直接通入水中,使气相和液相充分接触。水中溶解的游离氨穿过气液界面,向气相转移。从而达到脱除氨的目的。氨氮废水中NH3和NH4+平衡态的平衡关系有___。
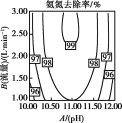
(2)温度、pH值、空气流量对脱除氨有很大的影响。pH值、空气流量对脱除氨影响如图所示。由图可以看出,空气流量一定时,10<pH<11时,吹脱率随着pH增加而增加,请用化学平衡移动原理解释原因___。
(3)次氯酸钠氧化法:利用次氯酸钠氧化废水中氨氮的离子方程式是___。
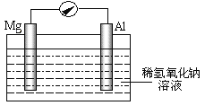
II.对于含有H2PO4-的氨氮废水还可以用电化学沉淀与阴极氧化协同去除水中的氨氮,装置如图所示。电解过程中,石墨毡电极产生OH-,在通入O2的情况,又产生H2O2,以氧化水中的NH4+,同时NH4+还可以通过生成MgNH4PO46H2O沉淀而持续被除去。
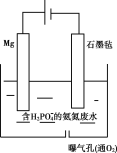
(1)阳极的电极反应式是___。
(2)废水中的NH4+'转化为MgNH4PO46H2O的离子方程式是___。
(3)pH大于10.5不利于MgNH4PO46H2O的生成,原因是___。
【答案】NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH- NH3·H2O
NH4++OH- NH3·H2O![]() NH4++OH-,pH增大有利于平衡逆向移动,NH4+转化为游离态的NH3,NH3在空气吹脱下从水中脱除 2NH4++3ClO-+2OH-=N2↑+3Cl-+5H2O Mg-2e-=Mg2+ NH4++H2PO4-+Mg2++2OH-+4H2O=MgNH4PO46H2O pH偏大,NH4+、Mg2+易与OH结合生成NH3H2O、Mg(OH)2,NH3H2O的电离被抑制,使NH4+和Mg2+浓度降低,不利于MgNH4PO46H2O的生成
NH4++OH-,pH增大有利于平衡逆向移动,NH4+转化为游离态的NH3,NH3在空气吹脱下从水中脱除 2NH4++3ClO-+2OH-=N2↑+3Cl-+5H2O Mg-2e-=Mg2+ NH4++H2PO4-+Mg2++2OH-+4H2O=MgNH4PO46H2O pH偏大,NH4+、Mg2+易与OH结合生成NH3H2O、Mg(OH)2,NH3H2O的电离被抑制,使NH4+和Mg2+浓度降低,不利于MgNH4PO46H2O的生成
【解析】
Ⅰ.(1)NH3极易溶于水,且与水反应生成一水合氨,一水合氨是弱电解质,部分电离生成NH4+和OH-,据此写出平衡关系;
(2)由NH3·H2O![]() NH4++OH-,pH增大,OH-增多,平衡逆向移动;
NH4++OH-,pH增大,OH-增多,平衡逆向移动;
(3)次氯酸根离子具有强氧化性,氧化NH4+生成氮气,本身被还原生成氯离子,根据得失电子守恒,写出离子反应方程式;
Ⅱ. (1)电解图可知,Mg电极为阳极,Mg失去电子,发生氧化反应;
(2)根据OH-、Mg2+、NH4+、H2PO4-反应生成MgNH4PO46H2O沉淀,写出离子反应方程式;
(3)pH偏大,NH4+、Mg2+易与OH结合生成NH3H2O、Mg(OH)2,据此分析解答;
Ⅰ.(1)NH3极易溶于水,且与水反应生成一水合氨,一水合氨是弱电解质,部分电离生成NH4+和OH-,所以氨氮废水中NH3和NH4+平衡态的平衡关系为:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,故答案为:NH3+H2O
NH4++OH-,故答案为:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-;
NH4++OH-;
(2)由NH3·H2O![]() NH4++OH-,pH增大,OH-增多,平衡逆向移动,NH4+转化为游离态的NH3,NH3在空气吹脱下从水中脱除,故答案为:NH3+H2O
NH4++OH-,pH增大,OH-增多,平衡逆向移动,NH4+转化为游离态的NH3,NH3在空气吹脱下从水中脱除,故答案为:NH3+H2O![]() NH4++OH-,pH增大有利于平衡逆向移动,NH4+转化为游离态的NH3,NH3在空气吹脱下从水中脱除;
NH4++OH-,pH增大有利于平衡逆向移动,NH4+转化为游离态的NH3,NH3在空气吹脱下从水中脱除;
(3)次氯酸根离子具有强氧化性,氧化NHspan>4+生成氮气,本身被还原生成氯离子,根据得失电子守恒,其离子反应方程式为:2NH4++3ClO-+2OH-=N2+3Cl-+5H2O,故答案为:2NH4++3ClO-+2OH-=N2+3Cl-+5H2O;
Ⅱ.(1)电解图可知,Mg电极为阳极,Mg失去电子,发生氧化反应,其电极反应式为:Mg-2e-=Mg2+,故答案为:Mg-2e-=Mg2+;
(2)石墨毡电极产生OH-,NH4+与Mg2+、NH4+、H2PO4-反应生成MgNH4PO46H2O沉淀,离子反应方程式为:NH4++H2PO4-+Mg2++2OH-+4H2O=MgNH4PO46H2O↓,故答案为:NH4++H2PO4-+Mg2++2OH-+4H2O=MgNH4PO46H2O↓;
(3)pH大于10.5,溶液中c(OH-)大,NH4+、Mg2+易与OH结合生成NH3H2O、Mg(OH)2,NH3H2O的电离平衡逆向移动,被抑制,使溶液中c(NH4+)与c(Mg2+)降低,不利于MgNH4PO46H2O沉淀的生成,故答案为:pH偏大,NH4+、Mg2+易与OH结合生成NH3H2O、Mg(OH)2,NH3H2O的电离被抑制,使NH4+和Mg2+浓度降低,不利于MgNH4PO46H2O的生成。

 阅读快车系列答案
阅读快车系列答案【题目】甲醇是重要的化工原料,可用于制备丙烯、氢气等。
(1)MTO法由甲醇制备丙烯时的反应原理是:甲醇先脱水生成二甲醚,然后二甲醚与甲醇的平衡混合物脱水转化为含丙烯较多的低聚烯烃。某温度下,在密闭容器中加入CH3OH气体,发生脱水反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g),一段时间后测得各组分的浓度如表所示。
CH3OCH3(g)+H2O(g),一段时间后测得各组分的浓度如表所示。
物质 | CH3OH | CH3OCH3 | H2O |
5min浓度(mol·L-1) | 0.44 | 0.6 | 0.6 |
10min浓度mol·L-1) | 0.04 | 0.8 | 0.8 |
15min浓度(molL-1) | 0.04 | 0.8 | 0.8 |
该温度下,反应的平衡常数数值是___,CH3OH的平衡转化率是___。
(2)利用甲醇水蒸气重整制氢法是获得氢气的重要方法。反应原理如下:
反应i(主反应):CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H=+49kJmol-1
CO2(g)+3H2(g)△H=+49kJmol-1
反应ii(副反应):H2(g)+CO2(g)![]() CO(g)+H2O(g)△H=+41kJmol-1
CO(g)+H2O(g)△H=+41kJmol-1
①温度高于300℃则会同时发生CH3OH转化为CO和H2的副反应,该反应的热化学方程式是___。
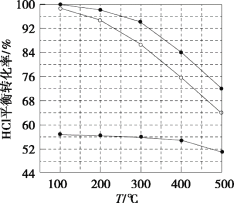
②反应中,经常使用催化剂提高化学反应速率,但催化剂对反应具有选择性。一定条件下,测得CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。

从图中可知,反应的适宜温度为___,随着温度的升高,催化剂对___(填“反应i”或“反应ii”)的选择性越低。
③TiO2纳米电极电化学还原法可将副产物CO2在酸性水溶液中电解生成甲醇,生成甲醇的电极反应式是___。