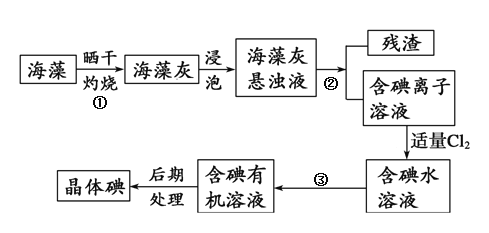
题目内容
【题目】常温下,某化学小组探究硝酸银溶液的性质。
装置 | 实验序号 | 实验操作 | 实验现象 |
| 实验I | 向试管中滴加2%氨水并不断振荡 | 产生棕褐色沉淀,继续滴加沉淀消失 |
实验II | 1.向试管中加入0.1mol·L-lNaOH溶液1mL 2.继续滴加3%H2O2至过量 | 1.产生棕褐色沉淀 2.产生大量无色无味气体,有黑色沉淀生成 | |
实验III | 1.向试管中滴加1mL0.1molL-1KI溶液 2.取少量上层清液于试管甲中,加入淀粉溶液 | 1.产生黄色沉淀 2.溶液无明显变化 |
已知:AgOH是一种白色固体,常温下极不稳定,易分解为棕褐色难溶于水的氧化银固体
(1)常温下,0.1mo1L-1AgNO3溶液pH约为4,请用离子方程式解释原因___。
(2)实验I中,反应的化学方程式是___。
(3)实验II中,经检验,黑色沉淀的成分为Ag。有Ag产生的化学方程式是___。经测定,实验产生的气体体积远远大于该反应的理论值,可能的原因是___。
(4)实验中,产生黄色沉淀的离子方程式是___。有同学猜想,I-有还原性,Ag+有氧化性,AgNO3溶液与KI溶液应该可以发生氧化还原反应。他设计了如图原电池,做实验IV证明了猜想成立。其中,在A烧杯中,石墨电极表面变亮,经检测这种光亮的物质为银单质。乙溶液是___,检验B烧杯中产物的操作及现象是___,该氧化还原反应的离子方程式是__。

(5)对比实验III和实验IV,实验III无I2生成的可能原因是___(写出两条)。
【答案】Ag++H2O![]() AgOH+H+ AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O Ag2O+H2O2=2Ag+O2+H2O Ag2O有催化作用,可以催化H2O2的分解,导致气体体积增大 Ag++I-=AgI↓ 0.1molL-1KI溶液 取少量反应后B烧杯中溶液,滴加淀粉溶液,有蓝色出现 2Ag++2I-=2Ag↓+I2 Ag+与I-发生氧化还原反应的速率慢于发生沉淀反应的速率;物质的氧化性还原性受浓度影响,溶液中离子浓度较小时,氧化还原反应不易发生
AgOH+H+ AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O Ag2O+H2O2=2Ag+O2+H2O Ag2O有催化作用,可以催化H2O2的分解,导致气体体积增大 Ag++I-=AgI↓ 0.1molL-1KI溶液 取少量反应后B烧杯中溶液,滴加淀粉溶液,有蓝色出现 2Ag++2I-=2Ag↓+I2 Ag+与I-发生氧化还原反应的速率慢于发生沉淀反应的速率;物质的氧化性还原性受浓度影响,溶液中离子浓度较小时,氧化还原反应不易发生
【解析】
(1)AgNO3为强酸弱碱盐,Ag+水解,溶液呈酸性;
(2)AgNO3溶液中滴加氨水,发生复分解反应,产生AgOH的白色沉淀,AgOH极不稳定,易分解为棕褐色难溶于水的Ag2O固体,继续滴加氨水,AgOH与氨水反应生成银氨溶液,沉淀消失,据此写出化学方程式;
(3)AgNO3溶液中加入NaOH溶液,发生复分解反应,产生AgOH的白色沉淀,AgOH极不稳定,易分解为棕褐色难溶于水的Ag2O固体,继续滴加H2O2至过量,AgO 被H2O2还原生成Ag单质;Ag2O有催化作用,催化H2O2分解生成O2,导致气体体积增大;
(4)AgNO3溶液中滴加KI溶液,发生复分解反应,产生AgI的黄色沉淀;在A烧杯中,石墨电极表面变亮,经检测这种光亮的物质为银单质,甲溶液为0.1molL-1AgNO3溶液,乙溶液是0.1molL-1KI溶液;用淀粉溶液,检验I2;根据得失电子守恒写出离子方程式;
(5)实验III中,Ag+与I-发生氧化还原反应的速率慢于发生沉淀反应的速率;物质的氧化性与还原性受浓度影响,溶液中离子浓度较小时,氧化还原反应不易发生;
(1)AgNO3为强酸弱碱盐,Ag+水解,溶液呈酸性,Ag++H2O![]() AgOH+H+,故答案为:Ag++H2O
AgOH+H+,故答案为:Ag++H2O![]() AgOH+H+;
AgOH+H+;
(2)AgNO3溶液中加氨水,发生复分解反应,产生AgOH的白色沉淀,AgNO3+NH3·H2O=AgOH↓+NH4NO3,AgOH极不稳定,易分解为棕褐色难溶于水的Ag2O固体,2AgOH=AgO+HO,继续加氨水,AgOH与氨水反应生成银氨溶液,沉淀消失,AgOH+2NH3·H2O=[Ag(NH3)2]OH+2H2O,则实验I中,发生的反应的化学方程式为:AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O,故答案为:
AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O;
(3)AgNO3溶液中加入NaOH溶液,发生复分解反应,产生AgOH的白色沉淀,AgNO3+NaOH=AgOH↓+NaNO3,AgOH极不稳定,易分解为棕褐色难溶于水的Ag2O固体,2AgOH=AgO+HO,继续滴加H2O2至过量,AgO 被H2O2还原生成Ag单质,其化学反应方程式为:Ag2O+H2O2=2Ag+O2+H2O;Ag2O具有催化作用,可以催化H2O2分解生成H2O和O2,导致气体体积增大,故答案为:Ag2O+H2O2=2Ag+O2+H2O;Ag2O有催化作用,可以催化H2O2的分解,导致气体体积增大;
(4)AgNO3溶液中滴加KI溶液,发生复分解反应,产生AgI的黄色沉淀,其离子反应方程式为:Ag++I-=AgI↓;在A烧杯中,石墨电极表面变亮,经检测这种光亮的物质为银单质,则A烧杯中发生的反应为:Ag++e-=Ag↓,甲溶液为0.1molL-1AgNO3溶液,则B烧杯中发生的反应为:2I--2e-=I2,乙溶液是0.1molL-1KI溶液;检验B烧杯中产物:取少量反应后B烧杯中溶液于试管中,滴加淀粉溶液,若有蓝色出现,则证明产物为I2;该氧化还原反应的离子方程式为:2Ag/span>++2I-=2Ag↓+I2,故答案为:Ag++I-=AgI↓;0.1molL-1KI溶液;取少量反应后B烧杯中溶液,滴加淀粉溶液,有蓝色出现;2Ag++2I-=2Ag↓+I2;
(5)对比实验III和实验IV,实验III中,Ag+与I-发生氧化还原反应的速率慢于发生沉淀反应的速率;物质的氧化性与还原性受浓度影响,溶液中离子浓度较小时,氧化还原反应不易发生,故答案为:Ag+与I-发生氧化还原反应的速率慢于发生沉淀反应的速率;物质的氧化性与还原性受浓度影响,溶液中离子浓度较小时,氧化还原反应不易发生。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案