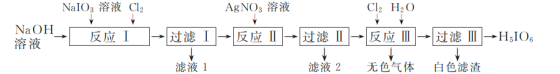
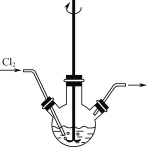
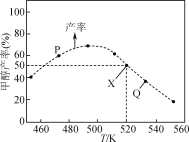
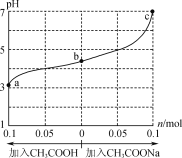
0 197297 197305 197311 197315 197321 197323 197327 197333 197335 197341 197347 197351 197353 197357 197363 197365 197371 197375 197377 197381 197383 197387 197389 197391 197392 197393 197395 197396 197397 197399 197401 197405 197407 197411 197413 197417 197423 197425 197431 197435 197437 197441 197447 197453 197455 197461 197465 197467 197473 197477 197483 197491 203614