题目内容
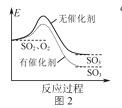
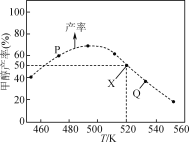
【题目】在体积为2L的恒容容器中,用CO2和H2合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。将1molCO2和3molH2在反应器中反应8小时,CH3OH的产率与温度的关系如图所示。下列说法正确的是( )
CH3OH(g)+H2O(g)。将1molCO2和3molH2在反应器中反应8小时,CH3OH的产率与温度的关系如图所示。下列说法正确的是( )
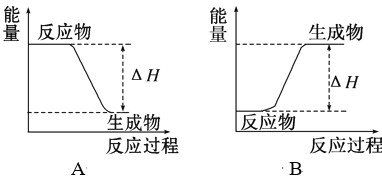
A.反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH>0
CH3OH(g)+H2O(g)的ΔH>0
B.图中P点所示条件下,延长反应时间能提高CH3OH的产率
C.图中Q点所示条件下,增加CO2的浓度可提高H2的转化率
D.520K时,反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡常数K=
CH3OH(g)+H2O(g)的平衡常数K=![]()
【答案】BC
【解析】
A.反应在CH3OH的产率达到最高点后达到平衡,随温度升高,CH3OH的产率降低,反应是放热反应,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH<0,故A错误;
CH3OH(g)+H2O(g)的ΔH<0,故A错误;
B.图中P点所示条件下,没有达到平衡,延长反应时间能提高CH3OH的产率,故B正确;
C.图中Q点所示条件下,增加CO2的浓度促进平衡正向移动,可提高H2的转化率,故C正确;
D.列出三段式:

520K时,反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡常数K=
CH3OH(g)+H2O(g)的平衡常数K=![]() ,故D错误;
,故D错误;
故选BC。

练习册系列答案
相关题目