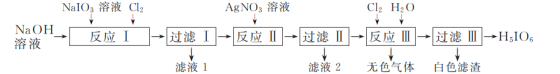
题目内容
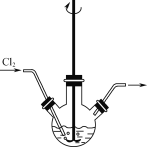
【题目】用如图所示装置进行下列实验:将①中的浓硫酸滴入②中,预测的现象与结论相符的是( )
A. 若②为浓盐酸;产生大量气体产生;说明硫酸的酸性比盐酸强
B. 若②为铜片;有气泡产生,底部生成灰白色固体;说明浓硫酸有强氧化性
C. 若②为蓝色硫酸铜晶体;蓝色晶体变为白色;说明浓硫酸有吸水性,发生物理变化
D. 若②为蔗糖;白色固体变为黑色海绵状,有气体放出;说明浓硫酸有脱水性、氧化性
【答案】D
【解析】
A.浓硫酸具有吸水性,浓盐酸具有挥发性,浓硫酸吸收浓盐酸中的水分导致浓盐酸浓度增大而加强其挥发性,浓硫酸和盐酸都是强酸,该实验体现浓盐酸的挥发性和浓硫酸的吸水性,故A错误。
B.常温下浓硫酸和Cu不反应,所以没有明显现象,故B错误。
C.浓硫酸具有吸水性,能吸收五水硫酸铜中的结晶水而使五水硫酸铜变为无水硫酸铜,固体由蓝色变为白色,该实验为化学变化,故C错误。
D.浓硫酸能将有机物中的H、0元素以2:1水的形式脱去而体现脱水性,还能将蔗糖脱水后形成的碳单质. 氧化为二氧化碳.同时还生成刺激性气味的二氧化硫,体现了浓硫酸的强氧化性.故D正确。
答案选D。
【题型】单选题
【结束】
9
【题目】已知NH4NO3在空气中爆炸时的反应为4NH4NO3![]() 3N2↑+2NO2↑+8H2O↑。下列说法不正确的是( )
3N2↑+2NO2↑+8H2O↑。下列说法不正确的是( )
A.NH4NO3在高温下爆炸时可以看到红棕色的烟雾
B.NH4NO3的含氮量小于氯化铵
C.实验室不能用NH4NO3固体与Ca(OH)2固体混合加热制备NH3
D.乘坐火车时不能携带NH4NO3固体
【答案】B
【解析】
A.根据NH4NO3的爆炸反应可知生成的NO2为红棕色,爆炸时,NO2、粉尘、H2O等形成了红棕色的烟雾,故A正确;
B.NH4NO3的含氮量为35%,NH4Cl的含氮量为26.2%,故B错误;
C.由于NH4NO3固体受热可能爆炸,故实验室不能用其制备NH3,故C正确;
D.NH4NO3属于易爆炸物,不能带上火车,故D正确;
故答案为B。

【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
【题目】Na2S2O3可用于照相业作定影剂等。实验室可通过Na2S、Na2CO3和SO2共同反应来制备,装置如图。

(1)仪器a的名称为____。
(2)A装置中,NaOH溶液的作用是___。
(3)D中生成Na2S2O3的化学方程式为___。
(4)装置C的作用有___、观察SO2的生成速率。若观察到SO2的生成速率过快,应进行的操作是___。
(5)本实验所需的Na2S可由硫化钠碱坯(主要含Na2S,还含少量Na2SO4、炭粉等杂质)制备。
已知Na2S的溶解度、固相成分与温度的关系如表:
温度/℃ | 溶解度/g | 固相 |
-10 | 10.3 | Na2S·9H2O+冰 |
10 | 13.6 | Na2S·9H2O |
20 | 18.7 | Na2S·9H2O |
40 | 28.5 | Na2S·9H2O |
48 | 35.7 | Na2S·9H2O+Na2S·6H2O |
60 | 39.1 | Na2S·6H2O |
80 | 49.1 | Na2S·6H2O |
91.5 | 61.3 | Na2S·6H2O+Na2S·5.5H2O |
请补充完整由硫化钠碱坯制备Na2S·9H2O晶体的实验方案:边搅拌边将适量蒸馏水加入硫化钠碱坯中,过滤,__,得到Na2S·9H2O晶体(须用的试剂:BaS、无水乙醇)。
【题目】碲(Te)元素是当今新材料的主要成分之一。工业上从电解法精炼铜的阳极泥中提取纯度较高的碲,经预处理后的阳极泥中含TeO2及铁、铅、铜的化合物等,通过以下流程得到:

已知:①TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。
②部分难溶物的Ksp如表:
化合物 | Fe(OH)2 | Pb(OH)2 | Cu(OH)2 | FeS | PbS | CuS |
Ksp | 8×10-16 | 1.2×10-15 | 1.3×10-20 | 4×10-19 | 1×10-28 | 6×10-36 |
回答下列问题:
(1)“碱浸”时TeO2发生反应的化学方程式为___________。
(2)加入Na2S溶液的主要目的是___________。
(3)“沉碲”发生反应的化学方程式为_______。
(4)“酸溶”后,将SO2通入溶液中进行“还原”得到粗碲,该反应的化学方程式是___________。
(5)电解法提纯粗碲时,以Na2TeO3溶液为电解质溶液,阳极材料为___________。电解过程中阴极的电极反应式为___________。
(6)常温下,向0.lmol/LNa2TeO3溶液中滴加盐酸,当溶液pH=5时,溶液中c(TeO32-):c(H2TeO3)=___________。(已知:H2TeO3的Ka1=1.0×10-3Ka2=2.0×10-8)