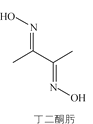
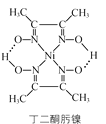
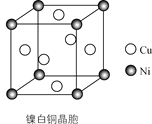
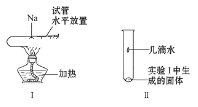
题目内容
【题目】3.2g铜与过量硝酸(8mol·L-1、30mL)充分反应,硝酸的还原产物为二氧化氮和一氧化氮,反应后溶液中含amol氢离子,则此时溶液中所含硝酸根离子的物质的量为( )
A.(0.2+a)molB.(0.1+a)mol
C.(0.05+a)molD.amol
【答案】B
【解析】
铜与浓硝酸可能发生反应的化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。硝酸铜的物质的量为![]() =0.05mol,溶液中所含硝酸根离子的物质的量为0.05mol×2+amol=(0.1+a)mol,故答案为B。
=0.05mol,溶液中所含硝酸根离子的物质的量为0.05mol×2+amol=(0.1+a)mol,故答案为B。
【点睛】
考查化学方程式的计算。注意浓硝酸和稀硝酸的性质的不同,明确二氧化氮或一氧化氮和硝酸的关系以及铜与硝酸(表现酸性)的关系式是解本题的关键。铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,根据混合气体的物质的量可得被还原的硝酸的物质的量,根据生成硝酸铜的物质的量可知表现酸性的硝酸的物质的量。
【题型】单选题
【结束】
11
【题目】为了防止钢铁零件生锈,常采用化学处理使钢铁零件表面生成Fe3O4的致密保护层——“发蓝”。化学处理过程中其中一步的反应为3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑。下列叙述不正确的是( )
A.钢铁零件“发蓝”实质上是使铁表面钝化
B.上述反应中,铁被氧化
C.NO2-的氧化性大于FeO22-的氧化性
D.反应中转移2mol电子,生成还原产物8.5g
【答案】D
【解析】
A.钢铁零件“发蓝”的过程是使钢铁零件表面生成Fe3O4的致密保护层,即铁表面钝化,故A正确;
B.该反应中铁被氧化成Na2FeO2,故B正确;
C.该反应中铁被氧化成Na2FeO2,NaNO2被还原成NH3,氧化剂是NaNO2,氧化产物是Na2FeO2,NO2-的氧化性大于FeO22-的氧化性,故C正确;
D.反应中转移2mol电子,生成还原产物NH3的质量约为5.7g,故D错误;
故答案为D。