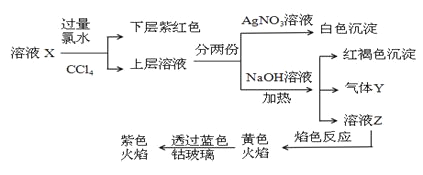
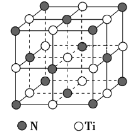
题目内容
【题目】下列说法正确的是( )
A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的ΔH>0,ΔS<0
B.常温下,将稀CH3COOH溶液加水稀释,溶液中![]() 的值不变
的值不变
C.在铜的精炼过程中,若转移1mol电子,则阴极析出Cu的质量为32g
D.一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,则其热化学方程式为N2(g)+3H2(g)=2NH3(g);ΔH=-38.6kJ·mol-1
【答案】C
【解析】
A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)能自发进行,应满足△H-T·△S<0,该反应为熵减反应,即△S<0,说明是放热反应,△H<0,故A错误;
B.常温下,将稀CH3COOH溶液加水稀释,由CH3COOH电离的CH3COO-、H+相等,醋酸浓度越稀,水电离程度越大,即氢离子的物质的量增大的幅度大,溶液中![]() 的值减小,故B错误;
的值减小,故B错误;
C.在铜的精炼过程中,若转移1mol电子,阴极为纯铜,被还原的全部为铜,阴极析出Cu的质量为32g,故C正确;
D.合成氨为可逆反应,0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,则1molN2和3molH2完全反应生成NH3(g),放热大于38.6kJ,则热化学方程式为N2(g)+3H2(g)![]() 2NH3(g)△H<-38.6kJ·mol-1,故D错误;
2NH3(g)△H<-38.6kJ·mol-1,故D错误;
故选C。

【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景。
(1)可用Pt/Al2O3、Pd/C、Rh/SiO2等作催化剂,采用如下反应来合成甲醇:2H2(g)+CO(g)CH3OH(g) ΔH<0
①如表所列数据是各化学键的键能,该反应的ΔH=______(用含字母的代数式表示)。
化学键 | H-H | C≡O | C-H | C-O | O-H |
键能/(kJ/mol) | a | b | c | d | e |
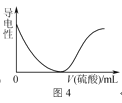
②在一定条件下,将1 molCO和2 molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
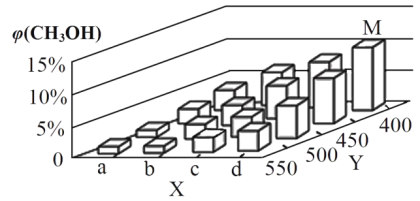
X轴上a点的数值比b点_________(填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是_______________。
(2)用CO2和H2合成甲醇:3H2(g) + CO2(g)CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 | |
起始反应物投入量 | 3molH2(g) 1molCO2(g) | 1molCH3OH(g) 1molH2O(g) | 2molCH3OH(g) 2molH2O(g) | |
平衡数据 | c(CH3OH)/molL-1 | c1 | c2 | c3 |
反应的能量变化/kJ | x | y | z | |
体系压强/Pa | p1 | p2 | p3 | |
反应物转化率 | α1 | α2 | α3 | |
①甲容器20s达到平衡时测得x=29.4,则甲中平均反应速率v(CO2)=______。
②下列说法错误的是________(填字母编号)。
A.2c2<c3 B.z>2y C.p3<2p1 D.α1+α3=1
(3)甲醇与水蒸气重整可以制氢。已知:
甲醇分解反应:CH3OH(g)CO(g) + 2H2(g) ΔH1=+90.64 kJ·mol-1
水蒸气变换反应:CO(g)+H2O(g)CO2(g)+H2(g) ΔH2=-41.20 kJ·mol-1
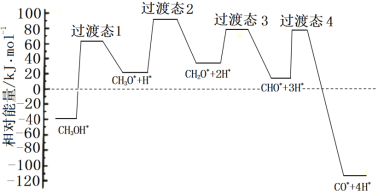
①科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。此历程中活化能最大的反应方程式为______________。
②573.2K时,向一刚性密闭容器中充入5.00MPaCH3OH使其分解,th后达平衡时容器中压强变为10.00MPa,其平衡常数分压Kp =_________。
③在0.1MPa下,将总进料量1mol且n(CH3OH):n(H2 O)=1:1.3的混合气体充入一刚性密闭容器中反应。实验测得水煤气变换反应的速率随温度的升高明显下降,原因是______________。