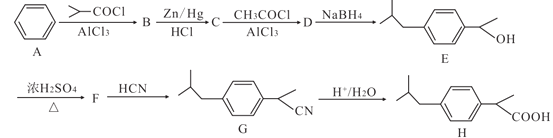
【题目】下表是A、B、C、D、E 五种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②空间充填模型 |
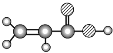
B | ① 由 C、H 两种元素组成;②空间充填模型为 |
C | ① 由 C、H、O 三种元素组成;②能与 Na 反应,但不能与 NaOH 溶液反应;③ 能与 E 反应生成酯 |
D | ① 相对分子质量比 C 少 2;②能由 C 氧化而成 |
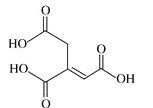
E | ① 由 C、H、O 三种元素组成;②球棍模型为 |
回答下列问题:
(1)A 在一定条件下发生聚合反应生成的高分子化合物的名称为_____。
(2)A 与氢气发生加成反应后生成 F,与 F 在分子组成和结构上相似的有机物有很多,它们均符合通式CnH2n+2(n为正整数)。当 n=_____时,这类有机物开始出现同分异构体。
(3)B 具有的性质是_____(填序号)。
①无色无味液体 ②密度比水的大 ③难溶于水 ④有毒 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥在一定条件下可与氢气反应
(4)在铁作用下,B 与液溴反应的化学方程式为_____。
(5)C能与E反应生成 酯 ,该反应的反应类型为_________; 其化学方程式为_______。
(6)由C氧化生成D 的化学方程式为_______。
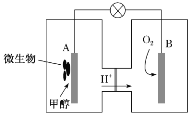
【题目】某化学实验小组用酸性 KMnO4 溶液和草酸(H2C2O4)溶液反应,研究外界条件对反应速率的影响,实验操作及现象如下:
编号 | 实验操作 | 实验现象 |
向一支试管中先加入 1mL 0.01 mol/L 酸性KMnO4 溶液,再加入 1 滴 3mol/L 硫酸和 9 滴蒸馏水,最后加入1mL 0.1mol/L 草酸溶液 | 前 10min 内溶液紫色无明显变化,后颜色逐渐变浅, 30 min 后几乎变为无色 | |
Ⅱ | 向另一支试管中先加入 1mL 0.01mol/L 酸性KMnO4 溶液,再加入 10 滴 3mol/L 硫酸,最后加入 1mL 0.1mol/L 草酸溶液 | 80s 内溶液紫色无明显变化,后颜色迅速变浅,约150s 后几乎变为无色 |
(1)将高锰酸钾与草酸反应的离子方程式补充完整__________:
□MnO![]() +□H2C2O4 + □ = □Mn2+ +□ +□H2O
+□H2C2O4 + □ = □Mn2+ +□ +□H2O
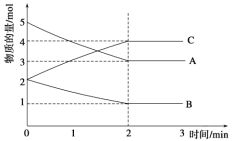
(2)由实验 I、Ⅱ可得出的结论是_____。
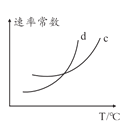
(3)关于实验Ⅱ中 80s 后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 Mn2+ 对反应有催化作用。设计实验 Ⅲ,验证猜想。
① 补全实验Ⅲ的操作:
向试管中先加入 1mL 0.01mol/L 酸性 KMnO4 溶液,_____,最后加入 1mL 0.1mol/L 草酸溶液。
②若猜想成立,应观察到的实验现象是________。