【题目】煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。完成下列填空:
(1)上述烟气处理过程中涉及到的化学物质组成元素中,属于第三周期元素的是___;写出N的核外电子排布式___。
(2)已知SO2分子的空间构型为折线形,则SO2为___(选填“极性”、“非极性”)分子。
(3)将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时问后,测得溶液中离子浓度的有关数据如下(其他离子忽略不计):
离子 | Na+ | SO42- | NO3- | OH- | Cl- |
浓度/(mol·L-1) | 5.5×10-3 | 8.5×10-4 | y | 2.0×10-4 | 3.4×10-3 |
①反应后溶液pH___7,表中y=___mol·L-1。
②写出NaClO2溶液吸收SO2的离子方程式___。
(4)烟气中的SO2还可采用氨法脱硫除去,其反应原理可用如图表示。
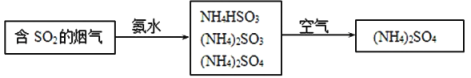
①写出SO2跟氨水反应生成NH4HSO3的化学方程式___。
②(NH4)2SO4溶液中浓度最大的离子是___。
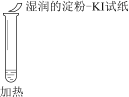
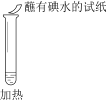
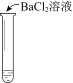
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化