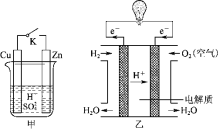
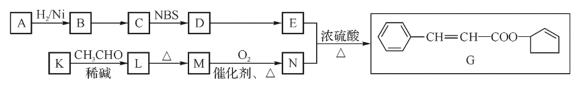
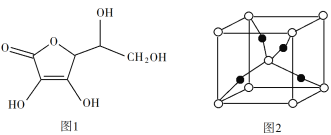
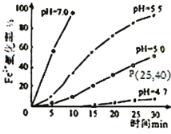
题目内容
【题目】常温下,以MnO2为原料制得的MnCl2溶液中常合有Cu2+、Pb2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是
A.过滤后的溶液中一定没有S2-
B.MnS难溶于水,可溶于MnCl2溶液中
C.常温时,CuS、PbS比MnS更难溶
D.加入MnS后生成CuS的离子方程式是Cu2++S2-→CuS↓
【答案】C
【解析】
A. 根据沉淀溶解平衡,过滤后的溶液中一定有S2-,故A错误;
B. MnCl2溶液中Mn2+浓度较大,使 MnS沉淀溶解平衡逆向移动,MnS在MnCl2溶液中的溶解度更小,故B错误;
C. 常温时, MnS可使Cu2+、Pb2+形成硫化物沉淀并过滤除去,所以 CuS、PbS比MnS更难溶,故C正确;
D. 加入MnS后生成CuS的离子方程式是Cu2+(aq)+MnS(s)![]() CuS(s)+ Mn2+ (aq),故D错误。
CuS(s)+ Mn2+ (aq),故D错误。

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目