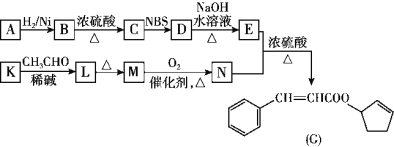
题目内容
【题目】臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为SO42-和NO3-,NOx也可在其他条件下被还原为N2。
(1)SO42-中心原子轨道的杂化类型为______;NO3-的空间构型为_____(用文字描述)。
(2)Fe2+基态核外电子排布式为_______。
(3)与O3分子互为等电子体的一种阴离子为________(填化学式)。
(4)(CN)2分子中σ键与π键的数目比n(σ)∶n(π)=________。
【答案】sp3 平面(正)三角形 [Ar]3d6或1s22s22p63s23p63d6 NO2- 1:2
【解析】
(1)根据价层电子对互斥理论和杂化轨道理论分析SO42-的中心S原子杂化类型和NO3-的空间构型;
(2)Fe位于周期表中第四周期第VⅢ族,Fe2+为Fe失去4s2电子所得;
(3)等电子体是指原子总数相同,价电子总数相同的粒子;
(4)(CN)2分子中C与N之间形成碳氮三键,其中有一个为σ键,两个为π键。
(1)对于SO42-,根据价电子对互斥理论,其价电子对数为4+![]() =4,所以根据杂化轨道理论,中心S原子杂化方式为sp3杂化;
=4,所以根据杂化轨道理论,中心S原子杂化方式为sp3杂化;
对于NO3-,根据价电子对互斥理论,其价电子对数为3+![]() =3,则其空间构型为平面(正)三角形;
=3,则其空间构型为平面(正)三角形;
(2)Fe是26号元素,位于元素周期表中第四周期第VⅢ族,Fe原子失去4s2电子形成Fe2+,则Fe2+基态核外电子排布式为:[Ar]3d6或1s22s22p63s23p63d6;
(3)等电子体是指原子总数相同,价电子总数相同的粒子,与O3分子互为等电子体的一种阴离子,可考虑将其中一个O原子替换为N原子,则O3的等电子体为NO2-;
(4)(CN)2分子中C与N之间形成碳氮三键,其中有一个为σ键,两个为π键,所以(CN)2分子中σ键与π键的数目比n(σ)∶n(π)=1:2。

 智能训练练测考系列答案
智能训练练测考系列答案