【题目】(1)比较下列粒子的半径大小
①Na Mg O F __________
②Na+ Mg2+ O2- F-__________
③Fe Fe2+ Fe3+__________
④Na+ Mg2+ S2- Cl-__________
(2)下列物质中:只存在共价键的是__________(填序号,下同),只存在离子键的是__________,既存在离子键又存在极性共价键的是__________,既存在离子键又存在非极性共价键的是__________。
①Ar ②CO2 ③Na2O2 ④KOH ⑤MgBr2 ⑥NH4Cl ⑦CaO ⑧H2SO4
(3)氢气可由天然气和水反应制备,其主要反应为:CH4(g)+ 2H2O(g) ===CO2(g)+4H2(g) 反应过程中能量变化如图所示,则该反应为__________反应(填“吸热”或“放热”)。若已知,破坏1mol化学键需要吸收的热量如代数式表示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | a | b | c | d |

则根据该反应制取1mol H2要吸收或放出热量为___________kJ(用含a、b、c、d字母表示)。
【题目】碳族元素的单质和化合物在化工、医药、材料等领域有着广泛的应用。
(1)锗是重要半导体材料,基态Ge原子中,核外电子占据最高能级的符号是______,该能级的电子云轮廓图为________。Ge的晶胞结构与金刚石类似,质地硬而脆,沸点2830℃,锗晶体属于_______晶体。
(2)(CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为_______,(CH3)3C+中碳骨架的几何构型为________。
(3)治疗铅中毒可滴注依地酸钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是_______。

A.形成依地酸铅离子所需n(Pb2+)∶n(EDTA)=1∶4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
D.依地酸具有良好的水溶性是由于其分子间能形成氢键
(4)下表列出了碱土金属碳酸盐的热分解温度和阳离子半径:
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
碱土金属碳酸盐同主族由上到下的热分解温度逐渐升高,原因是:__________。
(5)有机卤化铅晶体具有独特的光电性能,下图为其晶胞结构示意图:
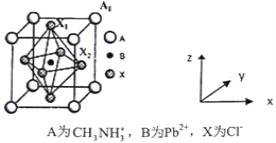
①若该晶胞的边长为anm,则Cl-间的最短距离是________。
②在该晶胞的另一种表达方式中,若图中Pb2+处于顶点位置,则Cl-处于____位置。