题目内容
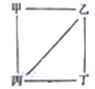
【题目】通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。已知乙二酸晶体加热分解的方程式为:H2C2O4·2H2O![]() 3H2O+CO2↑+CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。酒精喷灯可作高温热源。请回答下列问题:
3H2O+CO2↑+CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。酒精喷灯可作高温热源。请回答下列问题:
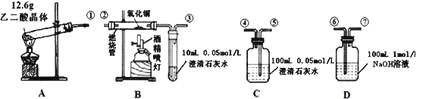
(1)检验装置A气密性的方法是
(2)按气流方向连接各仪器,用数字表示接口的连接顺序:
①→
(3)证明CO存在的实验现象是
(4)本实验尾气处理的方法是
(5)根据题给的数据,假设各反应均充分发生且产生的气体全部排出,并与吸收液充分反应(提示:B、C中澄清石灰水均先变浑浊,后又变澄清),D中溶质及对应的物质的量是: 。
【答案】(1)①处接长导管,将导管伸入盛有水的烧杯中,用手握住试管观察,若导管口产生气泡,松开手有小段水柱回流,则装置A气密性良好;
(2)⑤④⑥⑦②③
(3)B装置中黑色氧化铜变红,澄清石灰水变浑浊,则含CO;
(4)在导管③后放置一个燃着的酒精灯(或用气囊收集)
(5)0.01molNa2CO3和0.08molNaHCO3
【解析】试题分析:本题考查气体的检验,涉及装置气密性的检查,实验装置的连接,尾气的处理,与实验有关的计算。检验CO2用澄清的石灰水;检验CO,利用CO具有还原性,CO将CuO还原,自身被氧化成CO2,再检验CO的氧化产物CO2;由于CO2对CO的检验造成干扰,所以检验的顺序为:检验CO2→除尽CO2→检验CO,则装置的连接顺序为A→C→D→B,按气流方向,各仪器的连接顺序为①→⑤④→⑥⑦→②③。
(1)检查装置A的气密性用微热法,方法是:连好装置,①处接长导管,将导管伸入盛有水的烧杯中,用手握住试管观察,若导管口产生连续气泡,松开手有小段水柱回流,则装置A气密性良好。
(2)根据上述分析,按气流方向连接各仪器,用数字表示接口的连接顺序为:①→⑤④⑥⑦②③。
(3)证明存在CO的实验现象:B装置中黑色氧化铜变红,澄清石灰水变浑浊。
(4)本实验的尾气中含有CO和CO2,CO污染大气,由于CO难溶于水,与酸、碱、盐溶液均不反应,处理方法是:在导管③后放置一个燃着的酒精灯(或用气囊收集)。
(5)n(H2C2O4·2H2O)=![]() =0.1mol,根据方程式H2C2O42H2O
=0.1mol,根据方程式H2C2O42H2O![]() 3H2O + CO2↑+ CO↑,反应生成n(CO2)=0.1mol;C装置中n[Ca(OH)2]=0.05mol/L
3H2O + CO2↑+ CO↑,反应生成n(CO2)=0.1mol;C装置中n[Ca(OH)2]=0.05mol/L![]() 0.1L=0.005mol,C装置中澄清石灰水先变浑浊后又变澄清,C装置中反应为2CO2+Ca(OH)2=Ca(HCO3)2,C装置中消耗CO2物质的量为0.005mol
0.1L=0.005mol,C装置中澄清石灰水先变浑浊后又变澄清,C装置中反应为2CO2+Ca(OH)2=Ca(HCO3)2,C装置中消耗CO2物质的量为0.005mol![]() 2=0.01mol;进入D装置中的CO2物质的量为0.1mol-0.01mol=0.09mol,D装置中n(NaOH)=1mol/L
2=0.01mol;进入D装置中的CO2物质的量为0.1mol-0.01mol=0.09mol,D装置中n(NaOH)=1mol/L![]() 0.1L=0.1mol,1:1
0.1L=0.1mol,1:1![]() n(NaOH):n(CO2)=0.1mol:0.09mol=10:9
n(NaOH):n(CO2)=0.1mol:0.09mol=10:9![]() 2:1,则D装置中CO2和NaOH完全反应生成Na2CO3和NaHCO3,根据Na+守恒列式2n(Na2CO3)+n(NaHCO3)=0.1mol,根据C守恒列式n(Na2CO3)+n(NaHCO3)=0.09mol,解得n(Na2CO3)=0.01mol,n(NaHCO3)=0.08mol;D中最终生成的生成物Na2CO3物质的量为0.01mol,NaHCO3物质的量为0.08mol。
2:1,则D装置中CO2和NaOH完全反应生成Na2CO3和NaHCO3,根据Na+守恒列式2n(Na2CO3)+n(NaHCO3)=0.1mol,根据C守恒列式n(Na2CO3)+n(NaHCO3)=0.09mol,解得n(Na2CO3)=0.01mol,n(NaHCO3)=0.08mol;D中最终生成的生成物Na2CO3物质的量为0.01mol,NaHCO3物质的量为0.08mol。