题目内容
【题目】常温下,HA的电离常数Ka=1×10-6,向20 mL浓度为0.01 mol·L-1的HA溶液中逐滴加入0.01mol·L-1的NaOH溶液,溶液的pH与加入NaOH溶液的体积之间的关系如图所示,下列说法正确的是( )

A.a点对应溶液的pH约为4,且溶液中只存在HA的电离平衡
B.b点对应溶液中:c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
C.d点对应溶液中:c(OH-)-c(H+)=c(A-)
D.a、b、c、d四点对应的溶液中水的电离程度:a<b<c<d
【答案】D
【解析】
A.a点为0.01 mol·L-1的HA溶液,此时溶液中存在HA和H2O的电离平衡,故A错误;
B.b点为在20mL0.01 mol·L-1的HA溶液中滴加10mL0.01 mol·L-1的NaOH溶液,此时溶液中NaH和HA等物质的量混合,溶液pH<7,说明HA的电离程度大于A-的水解程度,则c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-),故B错误;
C.d点为滴加20mLNaOH溶液,此时恰好完全中和生成NaA,溶液中存在的电荷守恒式为c(OH-)+c(A-)=c(H+)+c(Na+),物料守恒式为c(Na+)=c(A-)+c(HA),则c(OH-)-c(H+)=c(HA)<c(A-),故C错误;
D.a点为HA溶液,b点是HA和NaA等浓度的混合溶液,c点是NaA和少量HA的混合液且溶液pH=7,d点是NaA的溶液,酸、碱溶液都抑制了水的电离,NaA促进水的电离,且所含NaA的浓度越大,溶液中水的电离程度越大,则a、b、c、d四点对应的溶液中水的电离程度:a<b<c<d,故D正确;
故答案为D。

 名校课堂系列答案
名校课堂系列答案【题目】I. 下列实验方案合理的是________。
A.配制银氨溶液:在一定量AgNO3溶液中,滴加氨水至沉淀恰好溶解
B.在检验醛基配制Cu(OH)2悬浊液时,在一定量CuSO4溶液中,加入少量NaOH溶液
C.验证RX为碘代烷,把RX与烧碱水溶液混合加热,将溶液冷却后再加入硝酸银溶液
D.无水乙醇和浓硫酸共热到170 ℃,将制得的气体通入酸性高锰酸钾,可检验制得的气体是否为乙烯
E.乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷
F.除去混在苯中的少量苯酚,加入过量溴水,过滤
G.实验室制取乙烯时必须将温度计的水银球插入反应液中,测定反应液的温度
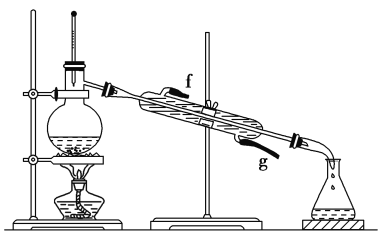
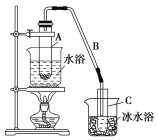
II.某化学小组采用类似制乙酸乙酯的装置(如下图),以环己醇制备环己烯。
已知: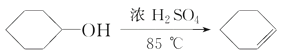 +H2O
+H2O
密度(g·cm-3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品:
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是________________,②导管B除了导气外还具有的作用是__________。
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________(填“上”或“下”)层,分液后用______(填编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从________(填“f”或“g”)口进入。