【题目】已知:2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g)。向容积均为2 L的甲、乙恒温容器中分别加入含 Cl2和NH3各2 mol的混合物,测得容器中n(Cl2)随反应时间t变化情况如下表。下列说法正确的是( )
NHCl2(g)+2HCl(g)。向容积均为2 L的甲、乙恒温容器中分别加入含 Cl2和NH3各2 mol的混合物,测得容器中n(Cl2)随反应时间t变化情况如下表。下列说法正确的是( )
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲,400℃)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(乙,T℃)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
A. T<400B. 反应在0~40min内,Q>K
C. 120min时,甲乙容器中NH3的ν(正)相等D. 反应的△H<0
【题目】一定温度下,2L的恒容密闭容器中发生反应A(g)+2B(g)3C(g).反应过程中的部分数据如下表所示。下列说法正确的是( )
n/mol t/min | n(A) | n(B) | n(C) |
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
A.平衡状态时,c(C)=0.6mol/LB.该反应在10min后才达到平衡
C.05min用A表示的平均反应速率为0.06molL-1min-1D.物质B的平衡转化率为20%
【题目】关于下图所示原电池装置的说法错误的是( )
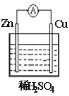
A.Zn为负极,反应为Zn-2e-=Zn2+B.铜棒上发生还原反应
C.电子从锌片经导线流向铜片D.溶液中氢离子浓度保持不变,溶液中SO42-向正极移动