题目内容
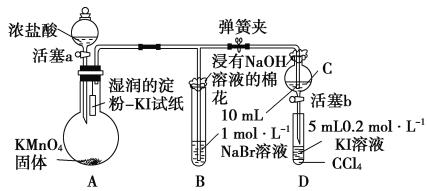
【题目】下列关于图示四个装置的叙述不正确的是( )

A. 装置甲的a端产生的气体能使湿润的淀粉碘化钾试纸变蓝
B. 装置乙可用于测定化学反应的反应热
C. 装置丙是可以在铁钉上镀铜的装置
D. 装置丁若为电解精炼铜装置,则X电极为精铜
【答案】B
【解析】
A.装置甲的a端接电源的正极,为阳极,氯离子放电生成氯气,氯气能使湿润的淀粉碘化钾试纸变蓝,故A正确;
B.测定反应热的实验过程中要用环形玻璃搅拌棒,环形玻璃棒在搅拌时与溶液的接触面积更大,使溶质充分快速反应,减少化学反应的时间,从而减少了化学反应中热量的散失,使反应后的温度测量更准确,故B错误;
C.电镀时,镀层金属作阳极,待镀金属作阴极,电镀液为含有镀层金属阳离子的溶液,所以装置丙可实现在铁钉上镀铜,故C正确;
D.电解精炼石纯铜作阴极,粗铜作阳极,丁装置中X电极为阴极,用精铜作阴极,故D正确。
故选B。

练习册系列答案
相关题目
【题目】有Ⅰ~Ⅳ四个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
容器 | 起始时 | ||
t/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |
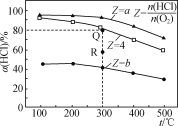
A. ΔH<0,a<4<b
B. 300℃该反应的平衡常数的值为64
C. 容器Ⅲ某时刻处在R点,则R点的υ正>υ逆,压强:p(R)>p(Q)
D. 若起始时,在容器Ⅳ中充入0.25molCl2和0.25molH2O(g),300℃达平衡时容器中c(HCl)=0.1mol·L-1