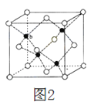
题目内容
【题目】一定条件下,向密闭恒容容器中加入1.0 mol·L-1X,发生反应:2X(g)![]() Y(g) + Z(g) ΔH<0。反应到8min时达 到平衡;在14min时改变温度,16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是( )
Y(g) + Z(g) ΔH<0。反应到8min时达 到平衡;在14min时改变温度,16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是( )
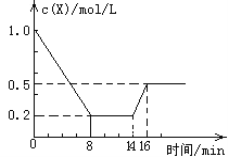
A. 0~8min用Y表示的该反应的速率为0.1mol·L-1·min-1
B. 8min时达到平衡,该反应的平衡常数为K=0.5
C. 14min时,改变的反应条件是降低了体系的温度
D. 16min时的正反应速率,比8min时的正反应速率大
【答案】D
【解析】
试题0~8min用X表示该反应速率为![]() 0.1mol·L-1·min-1,根据速率比等于系数比,用Y表示该反应速率为0.05mol·L-1·min-1,故A错误;
0.1mol·L-1·min-1,根据速率比等于系数比,用Y表示该反应速率为0.05mol·L-1·min-1,故A错误;
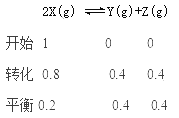
![]() 4,故B错误;14min时X的浓度增大,平衡逆向移动,改变的反应条是升高了温度,故C错误;16min时的温度大于8min,属于正反应速率16min时大,故D正确。
4,故B错误;14min时X的浓度增大,平衡逆向移动,改变的反应条是升高了温度,故C错误;16min时的温度大于8min,属于正反应速率16min时大,故D正确。

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目