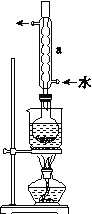
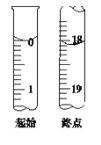
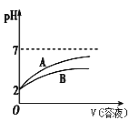
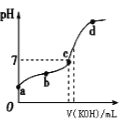
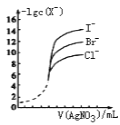
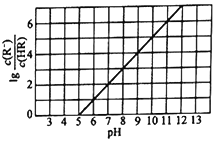
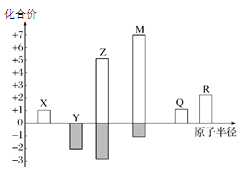
0 195561 195569 195575 195579 195585 195587 195591 195597 195599 195605 195611 195615 195617 195621 195627 195629 195635 195639 195641 195645 195647 195651 195653 195655 195656 195657 195659 195660 195661 195663 195665 195669 195671 195675 195677 195681 195687 195689 195695 195699 195701 195705 195711 195717 195719 195725 195729 195731 195737 195741 195747 195755 203614