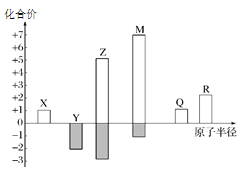
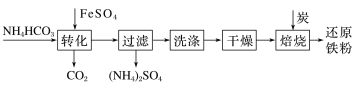
题目内容
【题目】碘是人类发现的第二个生命科学必需微量元素。回答下列问题:
(1)碘与氯是同族元素,它们位于元素周期表的第___族;HI的还原性比HCl___(填“强”或“弱”)。
(2)自然界中的碘有的以NaIO3形态存在于硝石(NaNO3)中,向硝石母液中加入NaHSO3可以制得I2,请写出NaIO3溶液和NaHSO3溶液反应的离子方程式____。
(3)碘还以碘化物的形态存在于海水中,被海藻类植物吸收而富集,从海带中提取碘的过程如下:

步骤③的操作名称为__;步骤④发生反应的离子方程式为___;步骤⑤的实验操作为____;
(4)步骤③得到的滤液中c(I-)=0.004mol/L,取10mL滤液加入10mLPb(NO3)2溶液,若要生成PbI2沉淀,则所加Pb(NO3)2溶液的浓度应大于___mol/L[已知Ksp(PbI2)=9.8×10-9]。
【答案】ⅦA 强 2IO3- +5HSO3-=I2 +5SO42-+3H+ +H2O 过滤 2I- +MnO2 +4H+=Mn2+ +I2 +2H2O 萃取(或萃取、分液) 4.9×10-3
【解析】
(1)氯位于周期表的第ⅦA族,碘和氯与是同族元素,所以碘也位于元素周期表的第ⅦA 族;HI的还原性比HCl强。故答案为:ⅦA,强;
(2)NaIO3溶液和NaHSO3溶液反应生成I2,碘的化合价降低,所以NaHSO3中硫的化合价升高,由+4价升高到+6价,根据电子守恒配平,得到反应的离子方程式为2IO3- +5HSO3-=I2 +5SO42-+3H+ +H2O;
(3)从海带灰的悬浊液得到含碘离子的溶液,需要经过过滤操作;从含碘的水溶液得到含碘的苯溶液,需要经过萃取分液。第④步碘离子被氧化为碘单质,MnO2做氧化剂,其本身被还原为Mn2+,酸性条件下的离子方程式为2I- +MnO2 +4H+=Mn2+ +I2 +2H2O,故答案为过滤,2I- +MnO2 +4H+=Mn2+ +I2 +2H2O,萃取(或萃取、分液);
(4)c(I-)=0.004mol/L,10mL滤液加入10mLPb(NO3)2溶液,溶液体积为20mL,所以此时溶液中的c(I-)=0.002mol/L,根据Ksp(PbI2)=9.8×10-9,可求得c(Pb2+)=![]() mol/L,所以所加Pb(NO3)2溶液的浓度应大于2.45×10-3mol/L ×2=4.9×10-3mol/L。
mol/L,所以所加Pb(NO3)2溶液的浓度应大于2.45×10-3mol/L ×2=4.9×10-3mol/L。

【题目】描述弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HNO2 | 4.6×10-4 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3·H2O | 1.8×10-5 |
表2
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10-10 |
BaCO3 | 2.6×10-9 |
CaSO4 | 7×10-5 |
CaCO3 | 5×10-9 |
请回答下列问题:
(1)表1所给的四种酸中,酸性最弱的是________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________(填字母序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________(选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系是_____________________________。
(3)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH >7,该溶液中离子浓度从大到小的排列为________________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01 mol·L-1,则溶液中CO32-物质的量浓度应 ≥ ______________。