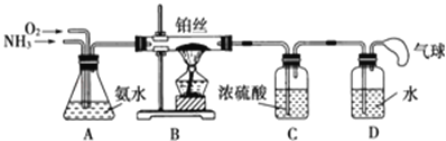
题目内容
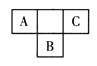
【题目】短周期元素A、B、C在周期表中所处的位置如图所示。A、B、C三种元素原子的质子数和为32。D元素原子的最外层电子数是其次外层电子数的2倍。则下列说法正确的是( )
A.四种元素形成的气态氢化物中,C元素的氢化物的稳定性最强
B.元素D的某种同位素质量数为14,则其中子数为6
C.B、C两种元素可形成BC6型化合物,该化合物属于离子化合物
D.A、B两种元素的气态氢化物均能与它们对应的最高价氧化物对应的水化物发生反应,且都属于氧化还原反应
【答案】A
【解析】
根据A、B、C三种元素在周期表中的相对位置,设A的原子序数是x,则B是x+9, C是x+2,A、B、C三种元素原子的质子数和为32,所以x+x+9+x+2=32,解得x=7,即A是N,B是S,C是F。D元素原子的最外层电子数为次外层电子数的2倍,D是碳元素。
A.元素的非金属性越强,氢化物的稳定性越强,F是最活泼的非金属,HF的稳定性最强,A正确;
B.碳的某种同位素质量数为14,则其中子数为14-6=8,B错误;
C.在SF6分子中,S与F之间形成共价键,SF6是共价化合物, C错误;
D.NH3和HNO3反应是化合反应,不是氧化还原反应,H2S和浓H2SO4反应是氧化还原反应,D错误;
故选A。

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目