14.在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol):下列说法不正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CO、2mol H2 | 1mol CH3OH | 2mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 平衡时压强(Pa) | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | c1=c3 | B. | a+c/2<90.7 | C. | 2P2>P3 | D. | α1+α3=1 |
12.科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2、压强1.0×105 Pa、反应时间3h):
相应的热化学方程式:N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1
回答下列问题:
(1)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化的示意图,并进行必要标注.
(2)与目前广泛使用的工业合成氨方法相比,该方法固氮反应速率慢.请提出可提高其反应速率且增大NH3生成量的建议:升高温度,增大反应物N2的浓度,不断移出生成物脱离反应体系.
(3)工业合成氨的反应为N2(g)+3H2(g)高温、高压催化剂
2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数为$\frac{4}{7}$.
①该条件下N2的平衡转化率为66.7%
②该条件下反应2NH3(g)高温、高压催化剂N2(g)+3H2(g)的平衡常数为0.005.
| T/℃ | 30 | 40 | 50 | 60 |
| NH3生成量/10-6 mol | 4.8 | 5.9 | 6.0 | 6.1 |

回答下列问题:
(1)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化的示意图,并进行必要标注.
(2)与目前广泛使用的工业合成氨方法相比,该方法固氮反应速率慢.请提出可提高其反应速率且增大NH3生成量的建议:升高温度,增大反应物N2的浓度,不断移出生成物脱离反应体系.
(3)工业合成氨的反应为N2(g)+3H2(g)高温、高压催化剂
2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数为$\frac{4}{7}$.
①该条件下N2的平衡转化率为66.7%
②该条件下反应2NH3(g)高温、高压催化剂N2(g)+3H2(g)的平衡常数为0.005.
11.将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入0.5L密闭容器内,550℃时,在催化剂作用下发生反应:2SO2(g)+O2(g)$?_{△}^{催化剂}$ 2SO3(g)(正反应放热).测得n(O2)随时间的变化如下表
4s后反应达到平衡,将容器中的混合气体通过过量NaOH溶液,气体体积减少了22.4L(此体积为标准状况下的体积);再将剩余气体通过焦性没食子酸的碱性溶液吸收O2(提示:焦性没食子酸的碱性溶液可以吸收O2),气体的体积又减少了5.6L(此体积为标准状况下的体积).请回答下列问题:
(1)用O2表示从0~2s内该反应的平均反应速率为0.4mol•L-1•s-1.
(2)O2的平衡浓度c(O2)=0.5mol•L-1.
(3)求该反应达到平衡时SO2的转化率是90%(用百分数表示).
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀10.5克(计算结果保留一位小数).
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(O2)/mol | 0.7 | 0.4 | 0.3 | x | x | x |
(1)用O2表示从0~2s内该反应的平均反应速率为0.4mol•L-1•s-1.
(2)O2的平衡浓度c(O2)=0.5mol•L-1.
(3)求该反应达到平衡时SO2的转化率是90%(用百分数表示).
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀10.5克(计算结果保留一位小数).
7.(1)已知:
①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)?CH3OH(g)△H3=-90.8kJ•mol-1
计算甲醇蒸气的燃烧热△H=-763.8kJ•mol-1
(2)在某温度下,发生可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.0kJ.mol-1
①向某容器中充入1.0molH2O(g)和1.0mol CO(g),在一定条件下发生上述反应.混合气体中CO的物质的量与时间关系如下表所示:
相对实验Ⅰ,实验Ⅱ可能改变的条件可能是增大压强(或缩小体积)、加催化剂,该温度下,平衡常数=1.
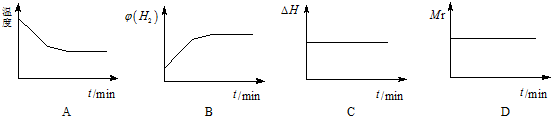
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应.下列图象正确且说明可逆反应达到平衡状态的是A.(填序号)(Mr为反应混合物的平均相对分子质量)
(3)对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的.汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ N2(g)+2CO2(g)△H=-QkJ/mol.
一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
前2s内的平均反应速率υ(N2)=1.88×10-4mol/(L•s);
达到平衡时,CO的转化率为25%.
(4)氨气是重要化工原料,在国民经济中占重要地位.在恒温、容积相等的恒容密闭容器中投入一定量氮气、氢气,发生如下可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.40kJ.mol-1 实验测得起始、平衡时的有关数据如表所示:
下列判断正确的是BC.
A.N2的转化率:Ⅱ>Ⅰ>ⅢB.放出热量:a<b<92.4n
C.达到平衡时氨气的体积分数:Ⅲ>ⅠD.平衡常数:Ⅲ>Ⅱ>Ⅰ
0 173774 173782 173788 173792 173798 173800 173804 173810 173812 173818 173824 173828 173830 173834 173840 173842 173848 173852 173854 173858 173860 173864 173866 173868 173869 173870 173872 173873 173874 173876 173878 173882 173884 173888 173890 173894 173900 173902 173908 173912 173914 173918 173924 173930 173932 173938 173942 173944 173950 173954 173960 173968 203614
①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)?CH3OH(g)△H3=-90.8kJ•mol-1
计算甲醇蒸气的燃烧热△H=-763.8kJ•mol-1
(2)在某温度下,发生可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.0kJ.mol-1
①向某容器中充入1.0molH2O(g)和1.0mol CO(g),在一定条件下发生上述反应.混合气体中CO的物质的量与时间关系如下表所示:
| 0 | 5min | 10min | 15min | 20min | 25min | |
| Ⅰ(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
| Ⅱ(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应.下列图象正确且说明可逆反应达到平衡状态的是A.(填序号)(Mr为反应混合物的平均相对分子质量)

(3)对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的.汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ N2(g)+2CO2(g)△H=-QkJ/mol.
一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
达到平衡时,CO的转化率为25%.
(4)氨气是重要化工原料,在国民经济中占重要地位.在恒温、容积相等的恒容密闭容器中投入一定量氮气、氢气,发生如下可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.40kJ.mol-1 实验测得起始、平衡时的有关数据如表所示:
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| Ⅰ | 3 n | n | 0 | 放出热量a kJ |
| Ⅱ | 3 n | 2 n | 0 | 放出热量b kJ |
| Ⅲ | 6 n | 2 n | 0 | 放出热量c kJ |
A.N2的转化率:Ⅱ>Ⅰ>ⅢB.放出热量:a<b<92.4n
C.达到平衡时氨气的体积分数:Ⅲ>ⅠD.平衡常数:Ⅲ>Ⅱ>Ⅰ
 氨是重要的氮肥,合成原理为:N2(g)+3H2(g)高温、高压催化剂
氨是重要的氮肥,合成原理为:N2(g)+3H2(g)高温、高压催化剂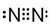 ;
;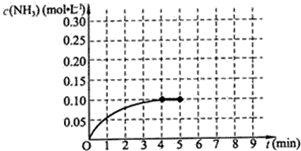 ac.(填序号).
ac.(填序号).