题目内容
9.在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g);△H<0(反应放热),反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:(1)根据如图,写出该反应达到平衡时H2的转化率50%.
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
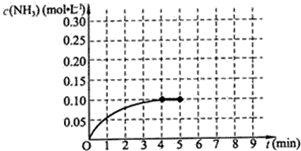 ac.(填序号).
ac.(填序号).a.0.20mol•L-1 b.0.12mol•L-1
c.0.10mol•L-1 d.0.08mol•L-1
(3)判断该反应达到平衡状态的标志是bc(填字母);
a.N2和NH3浓度相等
b.NH3百分含量保持不变
c.容器中气体的压强不变
d.2V(NH3)正=3V(H2)逆
e.容器中混合气体的密度保持不变
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol•L-1),请在图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
分析 (1)由图可知,4min达平衡,平衡时△c(NH3)=0.1mol/L,浓度变化量之比等于化学计量数之比,根据由方程式可知△c(H2)=$\frac{3}{2}$△c(NH3),再根据n=cV计算参加反应的氢气的物质的量,进而计算氢气的转化率;
(2)改变反应温度,平衡一定发生移动,氨气的浓度一定变化.若平衡逆向移动,氨气浓度减小,但氨气不能完全转化,若平衡正向移动,氨气浓度增大,但氮气不能完全转化为氨气;
(3)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
(4)第5分钟末将容器的体积缩小一半后,瞬间氨气的浓度变为原平衡的2倍,压强增大,平衡正向移动,氨气的浓度增大,在第8分钟末达到新的平衡时NH3的浓度约为0.25mol•L-1..
解答 解:(1)由图可知,4min达平衡,平衡时△c(NH3)=0.1mol/L,浓度变化量之比等于化学计量数之比,根据由方程式可知△c(H2)=$\frac{3}{2}$△c(NH3)=$\frac{3}{2}$×0.1mol/L=0.15mol/L,故参加反应的氢气的物质的量为0.15mol/L×2L=0.3mol,所以氢气的转化率为$\frac{0.3mol}{0.6mol}$×100%=50%,
故答案为:50%.
(2)温度改变平衡一定发生移动,则NH3的物质的量浓度不可能为0.1mol/L,若平衡逆向移动,氨气浓度减小,氨气不能完全转化,故0<c(NH3)<0.1mol/L,若平衡正向移动,氨气浓度增大,由于是可逆反应,氮气不能完全转化应,则0.1mol/L<c(NH3)<0.2mol/L,
故选:ac;
(3)a.N2和NH3浓度关系与氮气的转化率有关,平衡时不一定相等,故a错误;
b.NH3百分含量保持不变,说明反应到达平衡,故b正确;
c.随反应进行,混合气体物质的量减小,恒温恒容下气体压强减小,容器中气体的压强不变,说明反应到达平衡,故c正确;
d.应是3v(NH3)正=2v(H2)逆时,反应到达平衡,故d错误;
e.混合气体总质量不变,容器容积不变,容器中混合气体的密度始终保持不变,故e错误,
故选:bc;
(4)第5分钟末将容器的体积缩小一半后,瞬间氨气浓度为0.40mol/L,压强增大,平衡正向移动,氨气的浓度增大,在第8分钟末达到新的平衡时NH3的浓度约为0.50mol•L-1,第5分钟末到平衡时NH3浓度的变化曲线图象为: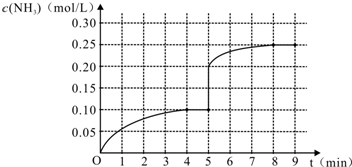 .
.
点评 本题考查化学平衡的计算与影响因素、化学平衡图象、平衡平衡状态判断、化学平衡的建立等,题目难度中等,(4)中作图注意缩小体积瞬间,氨气浓度变为原来的2倍.

 小学课时特训系列答案
小学课时特训系列答案| A. | 向 FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| B. | NaClO溶液 FeCl2溶液混合 2ClO-+Fe2++2H2O=Fe(OH)2↓+2HClO | |
| C. | 在强碱中NaClO与Fe(OH)3生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO${\;}_{4}^{2-}$+3Cl-+H2O+4H+ | |
| D. | 用铜做电极电解 CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+ |
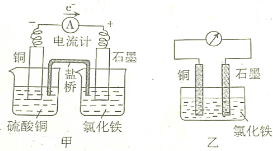
| A. | 甲、乙装置中的负极(或正极)反应式不同 | |
| B. | 放电少许时间后,甲、乙装置石墨极质量均增加 | |
| C. | 放电少许时间后,甲装置左边烧杯中含有两种溶质 | |
| D. | 甲、乙装置的能量转化形式不同 |
| A. | 0.1mol•L-1NH4HCO3溶液中:c(NH4+)+c(H+)=c(OH-)+c(HCO3-) | |
| B. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 欲使Na2S溶液中c(Na+)于c(S2-)的比值恰好为2:1,可加入适量的KHS溶液 |
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CO、2mol H2 | 1mol CH3OH | 2mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 平衡时压强(Pa) | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | c1=c3 | B. | a+c/2<90.7 | C. | 2P2>P3 | D. | α1+α3=1 |
aA(g)+bB(g)?2C(g)
起始浓度(mol/L) 3.0 1.0 0
2s末浓度(mol/L) 1.8 0.6 0.8
据此可推算出上述方程式中各物质的计量数之比是( )
| A. | 9:3:4 | B. | 3:1:2 | C. | 2:1:3 | D. | 3:2:1 |
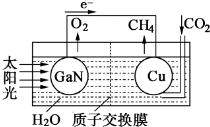 ,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O.为提高该人工光合系统的工作效率,可向装置中加入少量硫酸(填“盐酸”或“硫酸”).
,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O.为提高该人工光合系统的工作效率,可向装置中加入少量硫酸(填“盐酸”或“硫酸”).
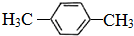 .(相对原子量:C-12 H-1)
.(相对原子量:C-12 H-1)