题目内容
13. 氨是重要的氮肥,合成原理为:N2(g)+3H2(g)高温、高压催化剂
氨是重要的氮肥,合成原理为:N2(g)+3H2(g)高温、高压催化剂2NH3(g)△H=-92.4kJ•mol-1.回答下列问题:
在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各种物质的物质的量随时间的变化如图所示,回答下列问题:
(1)10min内以NH3表示的平均反应速率为0.005mol/(L.min)
(2)在10~20min内,NH3浓度变化的原因可能是A
A.使用了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
(3)第1次平衡:平衡常数K1=$\frac{(\frac{0.3mol}{2L})^{2}}{(\frac{0.25mol}{2L})(\frac{0.15mol}{2L})^{3}}$(带数据的表达式),第2次平衡时NH3的体积分数45.5%;
(4)在反应进行至25min时,曲线发生变化的原因:分离出0.1molNH3达第二次平衡时,新平衡的平衡常数K2等于K1(填“大于”、“小于”或“等于”).
分析 (1)根据反应速率=$\frac{\frac{△n}{V}}{△t}$计算;
(2)根据图象知,平衡向正反应方向移动,10min时是连续的,三种气体物质的速率增加倍数相同,说明为使用催化剂;
(3)化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,第2次平衡时NH3的体积分数等于氨气的含量;
(4)25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3;由图象可以看出,当反应进行到时35-40min,各物质的量不变.
解答 解:(1)根据反应速率v(NH3)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{(0.1-0)mol}{2L}}{10min}$=0.005mol/(L.min),故答案为:0.005mol/(L.min);
(2)由图象可知各组分物质的量变化增加,且10min时变化是连续的,20min达平衡时,△n(N2)=0.025mol×4=0.1mol,
△n(H2)=0.025mol×12=0.3mol,△n(NH3)=0.025mol×8=0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,缩小体积相当于增大压强,应该反应物的速率增加倍数大,降低温度,应该反应速率减小,增加NH3物质的量,逆反应速率增加的倍数大,故只有使用催化剂符合,
故选A;
(3)化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,由图象可知,20min达平衡时,n(N2)=0.025mol×10=0.25mol,n(H2)=0.025mol×6=0.15mol,n(NH3)=0.025mol×12=0.3mol,所以所以其平衡常数K=$\frac{C{\;}^{2}(NH{\;}_{3})}{C(N{\;}_{2})C{\;}^{3}(H{\;}_{2})}$=$\frac{(\frac{0.3mol}{2L})^{2}}{(\frac{0.25mol}{2L})(\frac{0.15mol}{2L})^{3}}$;第2次平衡时NH3的体积分数=$\frac{2.5mol}{2.5mol+2.25mol+0.75mol}$×100%=45.5%,
故答案为:$\frac{(\frac{0.3mol}{2L})^{2}}{(\frac{0.25mol}{2L})(\frac{0.15mol}{2L})^{3}}$;45.5%;
(4)第25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3;由图象可以看出,当反应进行到时35-40min,各物质的量不变,说明反应达到第二次平衡状态,平衡常数只受温度影响,温度不变,平衡常数不变,所以抽去0.1mol氨,此时平衡常数K将不变;
故答案为:分离出0.1molNH3;等于.
点评 本题考查化学平衡的计算、平衡移动的影响因素以及平衡状态的判断,注意对图象的分析,题目难度中等.

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案| A. | 8 | B. | 10 | C. | 12 | D. | 14 |
| A. | 4 mol | B. | 3.4 mol | C. | 2.8 mol | D. | 1.2 mol |
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
(2)该反应达到平衡时反应物X的转化率α等于45%;

(3)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图2所示),则曲线①、②、③改变的实验条件分别是:
①升高温度;
②使用催化剂;
③增大压强.
| A. | 2Na+2H2O=2NaOH+H2↑ | B. | Cl2+H2O═HCl+HClO | ||
| C. | 2H2O═2H2↑+O2↑ | D. | Na2O+H2O═2NaOH |
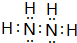
 环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为:
环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为: