题目内容
10.回答下列关于氮元素的氢化物和氧化物的问题:(1)氮元素原子的L层电子数为5,写出N2的电子式
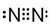 ;
;(2)在一定温度和压强及催化剂的条件下,在2L密闭容器中,通入一定量的氮气和氢气,发生如下反应:
N2+3H2?2NH3,开始时N2的物质的量浓度为4mol•L-1,2min后N2的物质的量浓度为2mol•L-1,则用N2表示的反应速率为1mol/(L•min); 2min时,NH3物质的量为8mol.
(3)已知各破坏1mol N≡N键、H-H键和N-H键分别需要吸收的能量为946kJ、436kJ、391kJ.理论计算
1mol N2(g)和3mol H2(g)完全转化为2mol NH3(g)的反应热△H=-92kJ•mol-1;
(4)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为2NH3+NaClO=N2H4+NaCl+H2O;
(5)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)=N2O4(1)△H1=-20.0kJ•mol-1
②N2H4 (1)+O2(g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
写出肼和N2O4 反应的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol.
分析 (1)氮元素为7号元素,原子的L层电子数为5,氮原子最外层有5个电子,氮原子之间形成三对共用电子对形成氮分子;
(2)根据v=$\frac{△c}{△t}$计算,根据转化的氮气的物质的量结合方程式可计算出生成氨气的物质的量;
(3)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算,化学反应中,反应物的总能量大于生成物的总能量,反应放热,反之吸热,以此计算反应热并判断吸热还是放热;
(4)NH3与NaClO反应可得到肼(N2H4),依据氧化还原反应化合价变化分析书写化学方程式:
(5)①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ?mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
根据盖斯定律:②×2-①得到肼和N2O4反应的化学方程,并据此计算反应热;
解答 解:(1)氮元素为7号元素,原子的L层电子数为5,氮原子最外层有5个电子,氮原子之间形成三对共用电子对形成氮分子,N2的电子式为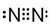 ,
,
故答案为:5;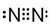 ;
;
(2)根据v=$\frac{△c}{△t}$可知,用N2表示的反应速率为$\frac{4mol•L{\;}^{-1}-2mol•L{\;}^{-1}}{2min}$=1mol/(L•min),根据题意,转化的氮气的物质的量为(4mol•L-1-2mol•L-1)×2L=4mol,根据方程式可知生成氨气的物质的量为2×4mol=8mol,
故答案为:1mol/(L•min);8mol;
(3)拆1molH-H键、1molN≡N、1molN-H键分别需要吸收的能量为436kJ、946kJ、391kJ,在反应N2+3H2?2NH3中,断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6molN-H键,放出的能量为:6×391kJ=2346kJ,所以反应热△H=2254kJ•mol-1-2346kJ•mol-1=-92kJ•mol-1,
故答案为:-92kJ•mol-1;
(4)NH3与NaClO反应可得到肼(N2H4),次氯酸钠做氧化剂,依据氧化还原反应的电子守恒和原子守恒写出该反应的化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O;故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(5)①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ?mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
根据盖斯定律:②×2-①得到肼和N2O4反应的热化学方程为:2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol,
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol.
点评 本题考查了电子式的书写、反应速率的计算、反应热的计算、盖斯定律的应用等知识,题目难度中等,注意基础知识的灵活运用.

| A. | 将CO2通过Na2O2使其增重ag时,反应中转移电子数为$\frac{a{N}_{A}}{14}$ | |
| B. | 将1molCl2通入水中,则 N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| C. | 2.24L的CH4中含有的C-H键数为0.4NA | |
| D. | 常温常压下,3.0g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA |
| A. | 1.4mol | B. | 2.4mol | C. | 3.8mol | D. | 5.2mol |
 已知某温度下:
已知某温度下:反应①:CO2(g)+H2(g)?CO(g)+H2O(g),△H=+41.2kJ/mol;
反应②:
 (g)?
(g)? (g)+H2(g),△H=+117.6kJ/mol.
(g)+H2(g),△H=+117.6kJ/mol.①、②的化学反应平衡常数分别为K1、K2.
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式CO2(g)+
 (g)?
(g)? (g)+CO(g)+H2O(g)△H=+158.8 kJ/mol.该反应的化学平衡常数K=K1•K2(用K1、K2表示).
(g)+CO(g)+H2O(g)△H=+158.8 kJ/mol.该反应的化学平衡常数K=K1•K2(用K1、K2表示).(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2.请画出t1之后的正逆反应曲线,并作出标注.
(3)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.50mol/L、c(N2O4)=0.125mol/L,则2NO2(g)═N2O4(g)的平衡常数K=0.5(写出计算结果);若NO2起始浓度为2mol/L,在相同条件下反应达到平衡时,NO2的转化率为50%.
(4)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)═CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应为吸热反应(填“吸热”、“放热”).
②能使该反应的反应速率增大,且平衡向正反应方向移动的是BC.
A.及时分离出CO气体 B.适当升高温度
C.增大CO2的浓度 D.选择高效催化剂.
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO${\;}_{3}^{2-}$ NO${\;}_{3}^{-}$ SO${\;}_{4}^{2-}$ SiO${\;}_{3}^{2-}$ |
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液于试管中,加入KSCN溶液后无明显变化.
Ⅲ.另取少量溶液于试管中,加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+(写离子符号).
(2)甲同学最终确定原溶液中所含阴离子是Cl-、NO3-、SO42-(写离子符号).
(3)Ⅲ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+═3Fe3++NO+2H2O.
(4)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为1.6g.
(5)工业废水中常含有不同类型的污染物,可采用不同的方法处理.以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是D.
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 碱性的废水 | 用CO2中和 | 化学法 |
 在某一容积为5L的密闭容器内,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g).反应中CO2的浓度随时间变化情况如图:
在某一容积为5L的密闭容器内,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g).反应中CO2的浓度随时间变化情况如图: