题目内容
12.科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2、压强1.0×105 Pa、反应时间3h):| T/℃ | 30 | 40 | 50 | 60 |
| NH3生成量/10-6 mol | 4.8 | 5.9 | 6.0 | 6.1 |

回答下列问题:
(1)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化的示意图,并进行必要标注.
(2)与目前广泛使用的工业合成氨方法相比,该方法固氮反应速率慢.请提出可提高其反应速率且增大NH3生成量的建议:升高温度,增大反应物N2的浓度,不断移出生成物脱离反应体系.
(3)工业合成氨的反应为N2(g)+3H2(g)高温、高压催化剂
2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数为$\frac{4}{7}$.
①该条件下N2的平衡转化率为66.7%
②该条件下反应2NH3(g)高温、高压催化剂N2(g)+3H2(g)的平衡常数为0.005.
分析 (1)催化剂是通过降低反应的活化能来加快化学反应速率的;
(2)平衡向正反应移动可增大氨气的产生量;升高温度,增大反应物浓度等可以增大反应速率;
(3)令参加反应的氮气的物质的量为nmol,根据三段式用n表示出各组分的物质的量的变化量、平衡时各组分的物质的量.在根据NH3的物质的量分数,列方程计算n的值;
①根据转化率的定义计算该条件下N2的平衡转化率;
②平衡常数指生成物浓度的系数次幂之积与反应物浓度系数次幂之积的比值,平衡常数k=$\frac{c{\;}^{3}(H{\;}_{2})•c(N{\;}_{2})}{{c}^{2}(N{H}_{3})}$,相同温度下,同一可逆反应的正逆平衡常数互为倒数关系.
解答 解:(1)催化剂是通过降低反应的活化能来加快化学反应速率的,使用催化剂后,活化能降低,图象为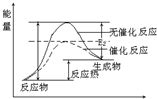 ,
,
故答案为: ;
;
(2)该反应正反应是吸热反应,升高温度,使化学平衡向正反应方向移动,从而增大NH3生成量,升高温度也能提高反应速率;增大反应N2浓度,加快反应速率,并使化学平衡向右移动;不断移出生成物脱离反应体系,使平衡向右移动,增大NH3生成量,
故答案为:升高温度,增大反应物N2的浓度,不断移出生成物脱离反应体系;
(3)对于反应N2(g)+3H2(g) 2NH3(g)
2NH3(g)
开始(mol):0.6 1.6 0
变化(mol):n 3n 2n
平衡(mol):0.6-n 1.6-3n 2n
所以 $\frac{2nmol}{(0.6-n)mol+(1.6-3n)mol+2nmol}$=$\frac{4}{7}$,解得n=0.4,
①由三段式解题法计算可知,平衡时参加反应的氮气的物质的量为0.4mol,
起始时,氮气的物质的量为0.6mol,
所以该条件下N2的平衡转化率为 $\frac{0.4mol}{0.6mol}$×100%=66.7%,
故答案为:66.7%;
②由三段式解题法计算可知,平衡时,c(N2)=$\frac{(0.6-0.4)mol}{2L}$=0.1mol/l;c(H2)=$\frac{(1.6-3×0.4)mol}{2L}$=0.2mol/l; c(NH3)=$\frac{2×0.4mol}{2L}$=0.4mol/l.
所以该条件下反应2NH3(g)?N2(g)+3H2(g)的平衡常数k=$\frac{c{\;}^{3}(H{\;}_{2})•c(N{\;}_{2})}{{c}^{2}(N{H}_{3})}$=$\frac{0.2{\;}^{3}×0.1}{0.4{\;}^{2}}$=0.005,
故答案为:0.005.
点评 本题考查平衡移动与计算、平衡常数等,难度不大,注意三段式解题法的利用.

| A. | (a+b)×63g | B. | (a+b)×169g | C. | [Vc-$\frac{9a+b}{3}$]mol | D. | (a+b)mol |
①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)?CH3OH(g)△H3=-90.8kJ•mol-1
计算甲醇蒸气的燃烧热△H=-763.8kJ•mol-1
(2)在某温度下,发生可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.0kJ.mol-1
①向某容器中充入1.0molH2O(g)和1.0mol CO(g),在一定条件下发生上述反应.混合气体中CO的物质的量与时间关系如下表所示:
| 0 | 5min | 10min | 15min | 20min | 25min | |
| Ⅰ(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
| Ⅱ(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应.下列图象正确且说明可逆反应达到平衡状态的是A.(填序号)(Mr为反应混合物的平均相对分子质量)
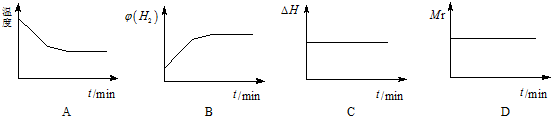
(3)对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的.汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ N2(g)+2CO2(g)△H=-QkJ/mol.
一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
达到平衡时,CO的转化率为25%.
(4)氨气是重要化工原料,在国民经济中占重要地位.在恒温、容积相等的恒容密闭容器中投入一定量氮气、氢气,发生如下可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.40kJ.mol-1 实验测得起始、平衡时的有关数据如表所示:
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| Ⅰ | 3 n | n | 0 | 放出热量a kJ |
| Ⅱ | 3 n | 2 n | 0 | 放出热量b kJ |
| Ⅲ | 6 n | 2 n | 0 | 放出热量c kJ |
A.N2的转化率:Ⅱ>Ⅰ>ⅢB.放出热量:a<b<92.4n
C.达到平衡时氨气的体积分数:Ⅲ>ⅠD.平衡常数:Ⅲ>Ⅱ>Ⅰ
| 物质 时间 | X | Y | Z | Q |
| 起始/mol | 0.7 | 1 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
(1)试确定以下物质的相关量:起始时n(Y)=2.3mol,平衡常数K=0.3(保留一位有效数字).
(2)写出反应的化学方程式X(g)+4Y(g)?2Z(g)+3Q(g).
(3)用Z表示2min内的反应速率0.05mol/(L.min).
(4)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ/mol
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:CO(g)+FeO(s)═Fe(s)+CO2(g)△H=-218.0kJ/mol.
| A. | 使用有少量蒸馏水的容量瓶配制溶液 | |
| B. | NaOH溶解后未冷却到室温即转移至容量瓶 | |
| C. | 移液后烧杯未用蒸馏水洗涤 | |
| D. | 定容时俯视液面 |
| A. | CO2 | B. | N2 | ||
| C. | NO2 | D. | 直径非常小的可吸入颗粒 |
 氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.