2. 某学生欲通过实验方法验证 Fe2+的性质.
某学生欲通过实验方法验证 Fe2+的性质.
(1)该同学在实验前,依据Fe2+的还原性,填写了表格.
依照表中操作,该同学进行实验,观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.为了进一步探究溶液变为深棕色的原因,该同学进行如下实验.
(2)向原新制FeSO4溶液和反应溶液后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
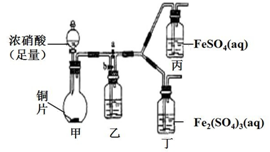
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe3+或Fe2+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
ⅰ打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液并无明显变化.
ⅱ打开活塞b、关闭a,一段时间后再停止甲中反应.ⅲ为与ⅰ中实验进行对照,更换丙丁后,使甲中反应继续,观察到的现象与步骤ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤ⅱ目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由Fe2+与NO或NO2作用得到.
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
 某学生欲通过实验方法验证 Fe2+的性质.
某学生欲通过实验方法验证 Fe2+的性质.(1)该同学在实验前,依据Fe2+的还原性,填写了表格.
| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红综色气体,溶液颜色逐渐变黄 | Fe2++NO${\;}_{3}^{-}$+2H+═Fe3++NO2↑+H2O |
(2)向原新制FeSO4溶液和反应溶液后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe3+或Fe2+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
ⅰ打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液并无明显变化.
ⅱ打开活塞b、关闭a,一段时间后再停止甲中反应.ⅲ为与ⅰ中实验进行对照,更换丙丁后,使甲中反应继续,观察到的现象与步骤ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤ⅱ目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由Fe2+与NO或NO2作用得到.
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
1.钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如图(废料中含有Al、Li、Co2O3和Fe2O3等物质).
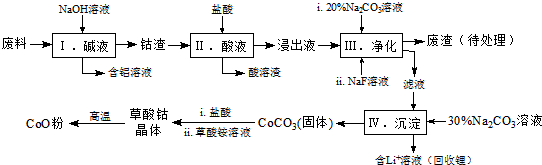
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表.
请回答:
(1)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(2)步骤Ⅲ中 Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过;废渣中的主要成分除了LiF外,还有Fe(OH)3.
(3)NaF 与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(4)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.已知:M(CoC2O4•2H2O)=183g/mol
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是3CoC2O4+2O2 $\frac{\underline{\;210℃-290℃\;}}{\;}$Co3O4+6CO2.温度高于890℃时,固体产物发生分解反应,固体产物为CoO.

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表.
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(2)步骤Ⅲ中 Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过;废渣中的主要成分除了LiF外,还有Fe(OH)3.
(3)NaF 与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(4)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.已知:M(CoC2O4•2H2O)=183g/mol
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
20.如表是25℃时某些弱酸的电离平衡常数.
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(2)pH 相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是:CH3COONa>NaClO,两溶液中:[c(Na+)-c(ClO-)]=[c(K+)-c(CH3COO-)](填“>”“<”或“=”).
(3)向 0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液 pH=5.
(4)碳酸钠溶液中滴加少量氯水的离子方程式为Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-.
| 化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(2)pH 相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是:CH3COONa>NaClO,两溶液中:[c(Na+)-c(ClO-)]=[c(K+)-c(CH3COO-)](填“>”“<”或“=”).
(3)向 0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液 pH=5.
(4)碳酸钠溶液中滴加少量氯水的离子方程式为Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-.
16.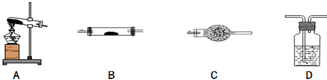 草酸亚铁晶体的化学式为FeC2O4•2H2O,它是一种淡黄色结晶粉末,有轻微刺激性,加热时可发生如下分解反应:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO2↑+CO↑+2H2O
草酸亚铁晶体的化学式为FeC2O4•2H2O,它是一种淡黄色结晶粉末,有轻微刺激性,加热时可发生如下分解反应:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO2↑+CO↑+2H2O
(1)请你用图中提供的仪器(可以重复选用,但每种仪器至少选用一次),选择必要的试剂[供选择的试剂:NaOH溶液、澄清石灰水、饱和碳酸钠溶液、CuO、无水硫酸铜、酸性高锰酸钾溶液],设计一个实验,检验FeC2O4•2H2O加热时分解产生的气态产物(包括水蒸气)(部分加热装置和夹持仪器在图中略去).在答题卡上填写表格(可以不用填满,也可以补充).
(2)按照题目提供的装置和要求设计的实验明显存在的一个不足是未对尾气进行处理,可造成环境污染.
(3)反应结束后,在A装置试管中有黑色固体粉末(混合物)产生,倒出时存在燃烧现象,产生上述现象的可能原因是FeC2O4•2H2O分解产生的CO将部分FeO还原为粉末状的单质铁,铁粉被空气中的氧气氧化而燃烧.
0 173732 173740 173746 173750 173756 173758 173762 173768 173770 173776 173782 173786 173788 173792 173798 173800 173806 173810 173812 173816 173818 173822 173824 173826 173827 173828 173830 173831 173832 173834 173836 173840 173842 173846 173848 173852 173858 173860 173866 173870 173872 173876 173882 173888 173890 173896 173900 173902 173908 173912 173918 173926 203614
 草酸亚铁晶体的化学式为FeC2O4•2H2O,它是一种淡黄色结晶粉末,有轻微刺激性,加热时可发生如下分解反应:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO2↑+CO↑+2H2O
草酸亚铁晶体的化学式为FeC2O4•2H2O,它是一种淡黄色结晶粉末,有轻微刺激性,加热时可发生如下分解反应:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO2↑+CO↑+2H2O(1)请你用图中提供的仪器(可以重复选用,但每种仪器至少选用一次),选择必要的试剂[供选择的试剂:NaOH溶液、澄清石灰水、饱和碳酸钠溶液、CuO、无水硫酸铜、酸性高锰酸钾溶液],设计一个实验,检验FeC2O4•2H2O加热时分解产生的气态产物(包括水蒸气)(部分加热装置和夹持仪器在图中略去).在答题卡上填写表格(可以不用填满,也可以补充).
| 仪器符号 | 仪器中所加物质 | 作用 |
| A | 草酸亚铁晶体 | 加热草酸亚铁晶体得到气体产物 |
| D | NaOH溶液 | |
(3)反应结束后,在A装置试管中有黑色固体粉末(混合物)产生,倒出时存在燃烧现象,产生上述现象的可能原因是FeC2O4•2H2O分解产生的CO将部分FeO还原为粉末状的单质铁,铁粉被空气中的氧气氧化而燃烧.
 某同学做如图实验,以检验反应中的能量变化.
某同学做如图实验,以检验反应中的能量变化.

 .
. ;F→G:
;F→G: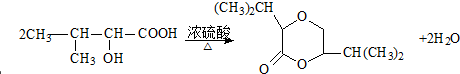 .
.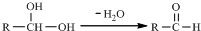 .请根据如图回答:
.请根据如图回答: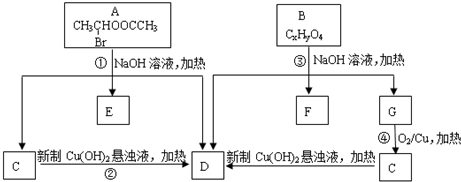
 .
. ;④
;④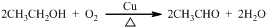 .
.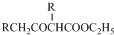 +C2H5OH
+C2H5OH E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.