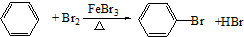题目内容
5.写出下列盐类水解的离子方程式,并指出其溶液的酸碱性.(1)硫酸铝溶液:Al3++3H2O?Al(OH)3+3H+(显酸性).
(2)硝酸铵溶液:NH4++H2O?NH3•H2O+H+(显_酸性).
(3)次氯酸钠溶液:ClO-+H2O?HlCO+OH-(显碱性).
(4)碳酸氢钠溶液:HCO3-+H2O?H2CO3+OH-(显碱性).
分析 (1)硫酸铝强酸弱碱盐,水解显酸性,铝离子水解生成氢氧化铝和氢离子;
(2)硝酸铵强酸弱碱盐,水解显酸性,铵根离子水解生成一水合氨和氢离子;
(3)次氯酸钠强碱弱酸盐,水解显碱性,次氯酸根离子水解生成次氯酸和氢氧根离子;
(4)碳酸氢钠为强碱弱酸盐,水解显碱性,碳酸氢根离子水解生成碳酸和氢氧根离子.
解答 解:(1)硫酸铝强酸弱碱盐,水解显酸性,铝离子水解生成氢氧化铝和氢离子,水解离子方程式:Al3++3H2O?Al(OH)3+3H+;溶液显酸性;
故答案为:Al3++3H2O?Al(OH)3+3H+;酸性;
(2)硝酸铵强酸弱碱盐,水解显酸性,铵根离子水解生成一水合氨和氢离子,水解离子方程式:NH4++H2O?NH3•H2O+H+,溶液呈酸性;
故答案为:NH4++H2O?NH3•H2O+H+,酸性;
(3)次氯酸钠强碱弱酸盐,水解显碱性,次氯酸根离子水解生成次氯酸和氢氧根离子,水解离子方程式:ClO-+H2O?HlCO+OH-,溶液呈碱性;
故答案为:ClO-+H2O?HlCO+OH-,碱性;
(4)碳酸氢钠为强碱弱酸盐,水解显碱性,碳酸氢根离子水解生成碳酸和氢氧根离子,水解离子方程式:HCO3-+H2O?H2CO3+OH-,溶液呈碱性;
故答案为:HCO3-+H2O?H2CO3+OH-,碱性;
点评 本题考查了离子方程式的书写,侧重考查盐类水解的离子方程式,明确盐类水解实质及规律是解题关键,题目难度不大.

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 298K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行,则其△H>0 | |
| B. | 乙醇、乙二醇、丙三醇互为同系物;H2、D2、T2互为同素异形体 | |
| C. | 用一定浓度的稀盐酸滴定未知浓度的氨水,若选用酚酞作指示剂,会使测定出的氨水物质的量浓度偏低 | |
| D. | 饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,涉及原理相同 |
16.化学与人类生产、生活、社会可持续发展密切相关.下列说法正确的是( )
| A. | 减少CO2的排放,可以减少酸雨的产生 | |
| B. | 为减少SO2的排放,可在燃煤中加入石灰石,这样可以从根本上消除雾霾 | |
| C. | “天宫一号”使用的碳纤维,是一种新型有机高分子材料 | |
| D. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
13.2015年9月28日,美国宇航局宣布发现了火星上存在液态水的证据.下列关于水的叙述正确的是( )
| A. | 水是一种重要的溶剂,能溶解所有的无机物和大多数有机物 | |
| B. | 水是一种重要的化学试剂,在一定条件下可与许多无机物和有机物发生反应 | |
| C. | 在氧化还原反应中,水只能作氧化剂,不能作还原剂 | |
| D. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等,在上述方法中都有化学反应发生 |
20.如表是25℃时某些弱酸的电离平衡常数.
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(2)pH 相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是:CH3COONa>NaClO,两溶液中:[c(Na+)-c(ClO-)]=[c(K+)-c(CH3COO-)](填“>”“<”或“=”).
(3)向 0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液 pH=5.
(4)碳酸钠溶液中滴加少量氯水的离子方程式为Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-.
| 化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(2)pH 相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是:CH3COONa>NaClO,两溶液中:[c(Na+)-c(ClO-)]=[c(K+)-c(CH3COO-)](填“>”“<”或“=”).
(3)向 0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液 pH=5.
(4)碳酸钠溶液中滴加少量氯水的离子方程式为Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-.
10.下列有关说法正确的是( )
| A. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 | |
| B. | 反应A(g)?2B(g);若正反应的活化能为Ea kJ•mol-1,逆反应的活化能为Eb kJ•mol-1,则该反应的△H=(Ea-Eb)kJ•mol-1 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,平衡时氢气转化率增大 | |
| D. | 吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0 |
14.对于BaSO4,不能将其划归( )类.
| A. | 钡盐 | B. | 硫酸盐 | C. | 难溶性盐 | D. | 可溶性盐 |
13.下列关于如图所示实验的说法正确的是( )
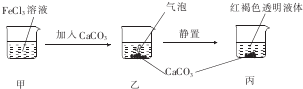

| A. | 甲、丙两液体均可产生丁达尔现象 | |
| B. | 乙中产生的气泡能使BaCl2溶液变浑浊 | |
| C. | 若忽略溶液体积的变化,则烧杯中c(Cl-)不变 | |
| D. | 若将CaC03换成CaS04,也可得到相同的实验现象 |
 如图所示为实验室制取少量溴苯的装置,回答下列问题:
如图所示为实验室制取少量溴苯的装置,回答下列问题: