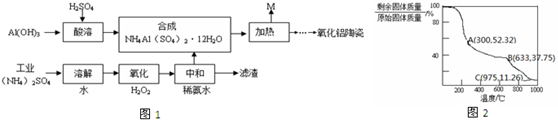
��Ŀ����
2��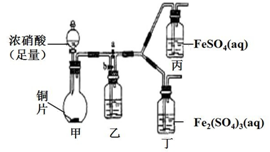 ijѧ����ͨ��ʵ�鷽����֤ Fe2+�����ʣ�
ijѧ����ͨ��ʵ�鷽����֤ Fe2+�����ʣ���1����ͬѧ��ʵ��ǰ������Fe2+�Ļ�ԭ�ԣ���д�˱���
| ʵ����� | Ԥ������ | ��Ӧ�����ӷ���ʽ |
| ��ʢ������FeSO4��Һ���Թ��е�������Ũ���ᣬ�� | �Թ��в�������ɫ���壬��Һ��ɫ��� | Fe2++NO${\;}_{3}^{-}$+2H+�TFe3++NO2��+H2O |
��2����ԭ����FeSO4��Һ�ͷ�Ӧ��Һ����Һ�о�����KSCN��Һ��ǰ�߲����ɫ�����߱�죮������Ľ�����Fe2+����������ΪFe3+��
��3����ͬѧͨ���������ϣ���Ϊ��Һ������ɫ������NO2��NO����Һ��Fe3+��Fe2+������Ӧ���õ��ģ�Ϊ����������ͼװ�ã��������Ѽ��飬β������װ���ԣ�����̽����
������a���ر�b����ʹ��װ���з�Ӧ��ʼ�۲쵽������Һ��Ϊ����ɫ����������Һ�������Ա仯��
������b���ر�a��һ��ʱ�����ֹͣ���з�Ӧ����Ϊ�뢡��ʵ����ж��գ�����������ʹ���з�Ӧ�������۲쵽�������벽�袡����ͬ��
��ͭ������Ũ���ᷴӦ�Ļ�ѧ����ʽ��Cu+4HNO3��Ũ��=Cu��NO3��2+2NO2��+2H2O��
��װ���ҵ�������ʹNO2ת��ΪNO��
�۲��袢Ŀ�����ų����Ҳ�װ���в�����NO2��
�ܸ�ʵ��ɵó��Ľ�������Һ������ɫ����Fe2+��NO��NO2���õõ���
��4����ͬѧ���½��У�1����ʵ�飬�۲쵽��Ԥ��������ʵ���������ʢ��Ũ������Թ��е�����������FeSO4��Һ����
���� ��1���������ӷ���ʽFe2++NO3-+2H+=Fe3++NO2+H2O��֪��Fe2+��ʾ��ԭ�ԣ�
��2��Fe3+��KSCN��Һ��Ѫ��ɫ��
��3��I������a���ر�bʱ����Ӧ���ɵ�NO2����ͨ����FeSO4��Һ�к�������ɫ����ͨ��Fe2��SO4��3��Һ��������
II������b���ر�a��������ʢװˮ��Һ��ʹNO2��ˮ��Ӧ����NO��
III��Ϊ�����ʵ����ж��գ�������������ʹ���з�Ӧ�������۲쵽�������벽�������ͬ����NOͨ��FeSO4��Һ��������ɫ����ͨ��Fe2��SO4��3��Һ��������
��ͭ��Ũ��������ΪCu��NO3��2��Ũ���ᱻ��ԭΪNO2���ݴ�д����ѧ����ʽ��
��װ����װ�е�Һ����ˮ��ʹ���ɵĶ�������������Ӧ3NO2+H2O=2HNO3+NO��
���ҵ��Ҳ�װ�����в�����NO2��
�ܸ���I��III��ʵ�����������
��4��ʵ��I��NO2����ͨ����FeSO4��Һ�к�������ɫ����ͨ��Fe2��SO4��3��Һ�������ݴ˷�����
��� �⣺��1�������ӷ���ʽFe2++NO3-+2H+=Fe3++NO2+H2O�У�Fe2+������ΪFe3+����ʾ��ԭ�ԣ�
�ʴ�Ϊ����ԭ��
��2����ԭ����FeSO4��Һ�кͷ�Ӧ����Һ�о�����KSCN��Һ��ǰ�߲����ɫ�����߱�죬������Fe3+��KSCN��Һ��Ѫ��ɫ���ʿ���˵����������ὫFe2+����Ϊ��Fe3+��
�ʴ�Ϊ��Fe2+����������ΪFe3+��
��3��I������a���ر�bʱ����Ӧ���ɵ�NO2����ͨ����FeSO4��Һ�к�������ɫ����ͨ��Fe2��SO4��3��Һ��������
II������b���ر�a��������ʢװˮ��Һ��ʹNO2��ˮ��Ӧ����NO��3NO2+H2O=2HNO3+NO��
III��Ϊ�����ʵ����ж��գ�������������ʹ���з�Ӧ�������۲쵽�������벽�������ͬ����NOͨ��FeSO4��Һ��������ɫ����ͨ��Fe2��SO4��3��Һ��������
��ͭ��Ũ��������ΪCu��NO3��2��Ũ���ᱻ��ԭΪNO2�����ݵ�ʧ�������غ��֪��ѧ����ʽΪ��Cu+4HNO3��Ũ��=Cu��NO3��2+NO2��+2H2O��
�ʴ�Ϊ��Cu+4HNO3��Ũ��=Cu��NO3��2+NO2��+2H2O��
��װ����װ�е�Һ����ˮ��������ͨ����Ӧ3NO2+H2O=2HNO3+NO��ʹNO2ת��ΪNO������֤NO����Һ��Fe 2+��Fe 3+�����ķ�Ӧ��
�ʴ�Ϊ��ʹNO2ת��ΪNO��
��װ�����в�����NO2��������Ҫ��Ӧһ��ʱ����������ɵ�NO���ų�װ���е�NO2���Ӷ����Ի�ô�����NO��
�ʴ�Ϊ���ų����Ҳ�װ���в�����NO2��
�ܸ���ʵ��I��III�������֪����Һ������ɫ����NO��NO2��Fe2+��Ӧ�õ��ģ�
�ʴ�Ϊ����Һ������ɫ����Fe2+��NO��NO2���õõ���
��4������ʵ��I��������NO2����ͨ����FeSO4��Һ�к�������ɫ����ͨ��Fe2��SO4��3��Һ�������ʿ�����ʢ��Ũ������Թ��е����������Ƶ�FeSO4��Һ����Ũ���ᱻ��ԭΪNO2��Fe2+������ΪFe3+����ʱ��ҺӦ�������Ե���ɫ�仯��
�ʴ�Ϊ����ʢ��Ũ������Թ��е�����������FeSO4��Һ����
���� ���⿼����Fe2+�Ļ�ԭ���Լ�NO��NO2��Fe2+�ķ�Ӧ��Fe2+�Ļ�ԭ�Ժ�Fe3+������һֱ�Ǹ�Ƶ���㣬Ӧ��ǿ���գ��ۺ��Խ�ǿ����Ŀ�Ѷ��еȣ�

| A�� | �κ�Ũ�ȵ���Һ��������pH����ʾ�����Ե�ǿ�� | |
| B�� | c��H+��=1��10-7 mol•L-1����Һһ����������Һ | |
| C�� | 0.2 mol•L-1 CH3COOH��Һ�е�c��H+����0.1 mol•L-1 CH3COOH��Һ�е�c��H+����2�� | |
| D�� | �����Ǵ�ˮ���������ԡ����Ի�����ϡ��Һ���ڳ����£���c��H+��•c��OH-�����Ƕ�ֵ |
 25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��
25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��| ��ѧʽ | CH3COOH | H2CO3 | HClO |
| ����ƽ�ⳣ�� | 1.7��10-5 | K1=4.3��10-7 K2=5.6��10-11 | 3.0��10-8 |
��1��CH3COOH��H2CO3��HClO��������ǿ������˳��ΪCH3COOH��H2CO3��HClO
��2��ͬŨ�ȵ�CH3COO-��HCO${\;}_{3}^{-}$��CO${\;}_{3}^{2-}$��ClO-���H+��������ǿ������˳��ΪCO32-��ClO-��HCO3-��CH3COO-
��3�����Ϊ10mL pH=2�Ĵ�����Һ��һԪ��HX�ֱ��ˮϡ����1 000mL��ϡ������pH�仯��ͼ��ʾ����HX�ĵ���ƽ�ⳣ�����ڣ�����ڡ��������ڡ���С�ڡ�������ĵ���ƽ�ⳣ����������ϡ����ͬ������HX��pH�仯��CH3COOH�Ĵ�����ǿ������ƽ�ⳣ����
| A�� | ˮ�����Ȼ�̼ | B�� | ʳ������ɳ | C�� | ��������Ȼ��� | D�� | �������Ȼ�̼ |
| A�� | CH4 | B�� | C2H6 | C�� | C3H8 | D�� | C3H4 |
| A�� | 0.2 mol/L CH3COONa��Һ��0.1 mol/L HCl��Һ�������Ϻ�c��CH3COO-����c��Na+����c��Cl-����c��H+����c��OH-�� | |
| B�� | pH=3�������NaNO3�Ļ����Һ�У�c��Na+��=c��Cl-�� | |
| C�� | 0.1 mol/L NaHCO3��Һ�У�c��Na+��+c��H+���Tc��HCO3-��+c��CO32-��+c��OH-�� | |
| D�� | ���ʵ���Ũ����ȵ�HCN�����ᣩ��NaCN��Һ�������Ϻ��У�c��HCN��+2c��H+���T2c��OH-��+c��CN-�� |