19.下列关于物质性质的说法不合理的是( )
| A. | SO2气体通入紫色石蕊试液中,溶液先变红后褪色 | |
| B. | FeCl3、Na2O2、Cu2S均可由相应单质直接化合生成 | |
| C. | 金属Mg与稀硫酸和CO2均能反应,其反应类型相同 | |
| D. | 氢氧化铝、碳酸铵、碳酸氢钠都既能与盐酸反应,又能与氢氧化钠溶液反应 |
18.下列有关说法正确的是( )
| A. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0 | |
| B. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | CH3COOH 溶液加水稀释后,溶液中的$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$值减小 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
14.下列说法正确的是( )
| A. | 向饱和食盐水中加入少量的浓盐酸,看不到明显的现象 | |
| B. | 将硫酸铜溶液与碳酸钠溶液混合,得到的沉淀是以Cu(OH)2为主,说明了在相同条件下Cu(OH)2的溶解度比CuCO3的更小 | |
| C. | 在0.01mol/L NaCl溶液中加入少量的AgNO3溶液,有白色沉淀生成,接着向上述溶液中加入足量的浓氨水,白色沉淀不会溶解 | |
| D. | CaCO3溶液的导电能力很弱,是因为CaCO3是弱电解质,存在如下电离平衡:CaCO3?Ca2++CO${\;}_{3}^{2-}$ |
13.二氧化碳捕捉与封存技术是实现室温气体减排的重要途径之一,科学家利用NaOH溶液喷淋“捕捉”空气中的二氧化碳.
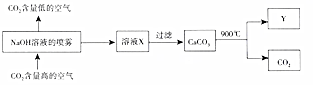
(1)二氧化碳的电子式是 .
.
(2)NaOH溶液喷成雾状的目的是增大气液反应物的接触面积,加快反应速率,提高二氧化碳的吸收率.
(3)若使用800mL1.0mol/LNaOH溶液吸收11.2L(标准状况)的CO2.
①反应的离子方程式是5CO2+8OH-=3CO32-+2HCO3-+3H2O.
②用所得溶液中的n(CO32-)、n(H2CO3)、n(H+)、n(OH-)这四个物理量建立一个代数式,使其值为0.3mol,即n(CO32-)-n(H2CO3)-n(H+)+n(OH-)等于0.3mol.
(4)该流程中可循环利用的物质有CaO、NaOH.
(5)某学习小组对碳酸钠和碳酸氢钠溶液进行了实验研究:
①步骤 I中,碳酸钠溶液的颜色较深,理由是碳酸根离子的水解程度大于碳酸氢根离子.
②加热碳酸钠溶液,红色变深的原因是升高温度,促进碳酸根离子的水解.
③加热碳酸氢钠溶液,溶液颜色也加深,除与碳酸钠相似的原因外,还可能有的原因是2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2↑(用化学方程式表示).

(1)二氧化碳的电子式是
 .
.(2)NaOH溶液喷成雾状的目的是增大气液反应物的接触面积,加快反应速率,提高二氧化碳的吸收率.
(3)若使用800mL1.0mol/LNaOH溶液吸收11.2L(标准状况)的CO2.
①反应的离子方程式是5CO2+8OH-=3CO32-+2HCO3-+3H2O.
②用所得溶液中的n(CO32-)、n(H2CO3)、n(H+)、n(OH-)这四个物理量建立一个代数式,使其值为0.3mol,即n(CO32-)-n(H2CO3)-n(H+)+n(OH-)等于0.3mol.
(4)该流程中可循环利用的物质有CaO、NaOH.
(5)某学习小组对碳酸钠和碳酸氢钠溶液进行了实验研究:
| 实验序号 | 实验操作 | 实验现象 |
| 步骤 I | 分别取等体积、等物质的量浓度的碳酸钠和碳酸氢铵溶液,滴加酚酞试液 | 两份溶液均变为红色 |
| 步骤 II | 加热两份溶液 | 溶液颜色均变深 |
| 步骤 III | 将上述两份溶液恢复到室温 | 碳酸钠溶液颜色恢复为原来的深浅;碳酸氢钠溶液的颜色也变浅,但比原先要深 |
②加热碳酸钠溶液,红色变深的原因是升高温度,促进碳酸根离子的水解.
③加热碳酸氢钠溶液,溶液颜色也加深,除与碳酸钠相似的原因外,还可能有的原因是2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2↑(用化学方程式表示).
12.向阳中学高二某小组同学设计并进行了一系列有关Fe2+与Fe3+的相关实验.
请回答下列问题:
(1)实验一步骤(I)中Fe(OH)2Cl与盐酸反应的离子方程式是Fe(OH)2Cl+2H+=Fe3++Cl-+2H2O.
(2)实验一步骤(II)中的实验现象是溶液变为浅绿色,且有无色气体生成;加入稍过量铁粉的作用是防止亚铁离子被氧化为铁离子.
(3)实验二步骤(II)中溶液变红的原因是2H++2Fe2++H2O2=2Fe3++2H2O、Fe3++3SCN-=Fe(SCN)3(用离子方程式表示).
(4)实验二步骤(II)中生成气体的化学方程式是2H2O2$\frac{\underline{\;铁离子\;}}{\;}$2H2O+O2↑.
(5)实验三步骤(I)中的黄色液体中含有的溶质微粒除了K+、Cl-,还有Fe3+、I-、Fe2+、I2;该反应的离子方程式是2Fe3++2I-?2Fe2++I2.
(6)完成实验四步骤(I)时所用的主要玻璃仪器是分液漏斗、烧杯.
(7)已知用KSCN检验Fe3+时,Fe3+的最低显色浓度为1×10-3mol/L.实验四中最终溶液不变红的原因是碘被萃取至CCl4中,水层中的c(I2)下降,平衡2Fe3++2I-?2Fe2++I2正向移动,多次萃取后,Fe3+的浓度下降至1×10-3mol/L以下,无法显色.
| 实验序号 | 实验步骤和操作 | 实验现象 |
| 实验一 | (I)取氧化亚铁固体[已部分变质,含有少量难溶于水的杂质Fe(OH)2Cl],向其中加入过量稀盐酸. (II)再加入稍过量的铁粉,振荡. | 固体完全溶解,溶液呈黄绿色 |
| 实验二 | (I)取实验一得到的溶液,加入KSCN溶液. (II)再加入少量H2O2溶液. | 无明显实验现象 溶液变红,有少量气泡 |
| 实验三 | (I)取10mL0.1mol/LKI溶液,滴加6滴0.1mol/L FeCl3溶液.(II)取少量上述黄色液体,滴加KSCN溶液. (III)另取上述黄色液体,加入淀粉溶液. | 溶液呈黄色 溶液变红 溶液变蓝 |
| 实验四 | (I)向实验三步骤I中所得的黄色溶液中加入2mLCCl4,充分振荡后,分离得到水层:重复操作三次. (II)向实验四步骤I中所得水层中加KSCN溶液. | 上层溶液无色 下层溶液为黄色 无明显实验现象 |
(1)实验一步骤(I)中Fe(OH)2Cl与盐酸反应的离子方程式是Fe(OH)2Cl+2H+=Fe3++Cl-+2H2O.
(2)实验一步骤(II)中的实验现象是溶液变为浅绿色,且有无色气体生成;加入稍过量铁粉的作用是防止亚铁离子被氧化为铁离子.
(3)实验二步骤(II)中溶液变红的原因是2H++2Fe2++H2O2=2Fe3++2H2O、Fe3++3SCN-=Fe(SCN)3(用离子方程式表示).
(4)实验二步骤(II)中生成气体的化学方程式是2H2O2$\frac{\underline{\;铁离子\;}}{\;}$2H2O+O2↑.
(5)实验三步骤(I)中的黄色液体中含有的溶质微粒除了K+、Cl-,还有Fe3+、I-、Fe2+、I2;该反应的离子方程式是2Fe3++2I-?2Fe2++I2.
(6)完成实验四步骤(I)时所用的主要玻璃仪器是分液漏斗、烧杯.
(7)已知用KSCN检验Fe3+时,Fe3+的最低显色浓度为1×10-3mol/L.实验四中最终溶液不变红的原因是碘被萃取至CCl4中,水层中的c(I2)下降,平衡2Fe3++2I-?2Fe2++I2正向移动,多次萃取后,Fe3+的浓度下降至1×10-3mol/L以下,无法显色.
11.关于下列叙述中正确的是( )
| A. | 同温同压下,相同体积的任何物质,其物质的量必相等 | |
| B. | 相同条件下的一氧化碳气体和氮气,若体积相等,则质量也相等 | |
| C. | 不同的气体,若体积不同,则它们所含的分子数也不同 | |
| D. | 在不同条件下,等物质的量的甲烷和一氧化碳所含的分子数一定不等 |
10.把aL硫酸铵和硝酸铵的混合液分成两等份,一份加入bmol 烧碱并加热,刚好把NH3 全部赶出.另一份需消耗含cmolBaCl2的水溶液,沉淀反应刚好完全.则原溶液中硝酸根离子的物质的量浓度为( )
0 173653 173661 173667 173671 173677 173679 173683 173689 173691 173697 173703 173707 173709 173713 173719 173721 173727 173731 173733 173737 173739 173743 173745 173747 173748 173749 173751 173752 173753 173755 173757 173761 173763 173767 173769 173773 173779 173781 173787 173791 173793 173797 173803 173809 173811 173817 173821 173823 173829 173833 173839 173847 203614
| A. | $\frac{b-2c}{a}$mol.L-1 | B. | $\frac{2b-c}{a}$mol.L-1 | C. | $\frac{a-b}{a}$mol.L-1 | D. | $\frac{2b-4c}{a}$mol.L-1 |
 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题: