题目内容
15.分类法在化学学科发展中起到了非常重要的作用,下列分类依据合理的是( )①根据氧化物的性质将氧化物分成酸性氧化物、碱性氧化物和两性氧化物等
②根据反应中是否有元素化合价变化将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否有丁达尔现象分为溶液、胶体和浊液
④根据组成元素的种类将纯净物分为单质和化合物
⑤根据化合物在水溶液中是否导电将物质分为电解质和非电解质
⑥根据碳酸钠溶于水呈碱性,碳酸钠既属于盐,又属于碱.
| A. | ②④⑥ | B. | ①②④ | C. | ①②③ | D. | ②③④⑥ |
分析 ①酸性氧化物、碱性氧化物和两性氧化物的分类是依据氧化物的性质进行分类;
②化学反应中元素化合价发生变化是氧化还原反应的判断依据;
③分散系的分类依据是分散质微粒直径大小分析判断;
④同种元素组成的纯净物为单质,不同种元素组成的纯净物为化合物;
⑤根据水溶液或熔融态是否能够导电将化合物分为电解质和非电解质;
⑥金属阳离子和酸根阴离子构成的化合物为盐,水溶液中电离出的阴离子全部是氢氧根离子的化合物为碱.
解答 解:①根据氧化物的性质将氧化物分成酸性氧化物、碱性氧化物等;能和碱反应生成盐和水的氧化物属于酸性氧化物;能跟酸起反应,生成盐和水的氧化物属于碱性氧化物,既能与酸反应,又能与碱反应,生成盐和水的氧化物属于两性氧化物,故①正确;
②化学反应中元素化合价是否发生变化把反应分为氧化还原反应和非氧化还原反应,故②正确;
③分散系的分类是依据分散质直径的大小,将分散系分为溶液、胶体、浊液,故③错误;
④单质是只由一种元素组成的纯净物,化合物是由两种或两种以上的元素组成的纯净物,故④正确;
⑤水溶液中或熔融状态导电的化合物为电解质,水溶液中和熔融状态不能导电的化合物为非电解质,⑤错误;
⑥碳酸钠的水溶液具有碱性,但是属于盐类,不属于碱类,故⑥错误;
故选B.
点评 本题考查物质的分类,题目难度不大,注意物质的分类的依据,不同的分类标准会得出不同的分类结果.

练习册系列答案
相关题目
6.下列有关化学用语的理解错误的是( )
| A. | 电子式 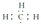 可以表示甲基,但不能表示CH3+ 可以表示甲基,但不能表示CH3+ | |
| B. | 比例模型 既能表示甲烷分子,也能表示四氯化碳分子 既能表示甲烷分子,也能表示四氯化碳分子 | |
| C. | C2H4O2可以表示乙酸、甲酸甲酯等物质 | |
| D. | 离子结构示意图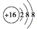 可以表示32S2-,也可以表示34S2- 可以表示32S2-,也可以表示34S2- |
3.在下列变化中,需加入氧化剂才能进行的是( )
| A. | KMnO4→MnO2 | B. | Na2CO3→CO2 | C. | Fe2+→Fe | D. | CO→CO2 |
10.把aL硫酸铵和硝酸铵的混合液分成两等份,一份加入bmol 烧碱并加热,刚好把NH3 全部赶出.另一份需消耗含cmolBaCl2的水溶液,沉淀反应刚好完全.则原溶液中硝酸根离子的物质的量浓度为( )
| A. | $\frac{b-2c}{a}$mol.L-1 | B. | $\frac{2b-c}{a}$mol.L-1 | C. | $\frac{a-b}{a}$mol.L-1 | D. | $\frac{2b-4c}{a}$mol.L-1 |
20.通过下列实验现象的分析,对实验事实的解释正确的是( )
| A. | 常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸反应 | |
| B. | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色,说明浓氨水呈碱性 | |
| C. | H2S能与CuSO4溶液反应生成H2SO4,说明氢硫酸的酸性比硫酸强 | |
| D. | 向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,说明BaCl2有酸性 |
7.NA为阿伏加德罗常数,下列说法错误的是( )
| A. | 0.1 mol的甲基(-CH3)与羟基(-OH)所含电子数均为NA | |
| B. | 1molD216O中含中子、质子、电子各10NA | |
| C. | 32 g S8单质(分子结构如右图)中含有的S-S键个数为NA | |
| D. | 1.5g CH3+中含有的电子数为0.8NA |
4.一定量的稀硫酸与过量的锌反应,为减慢反应速率,且不影响生成氢气的总量,可向稀硫酸中加入适量的下列物质,其中能达到目的是( )
| A. | 硝酸钠固体 | B. | 冰醋酸 | C. | 硫酸锌溶液 | D. | 硫酸铜固体 |