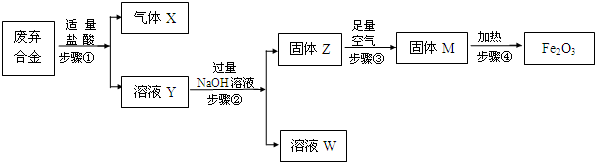
题目内容
11.关于下列叙述中正确的是( )| A. | 同温同压下,相同体积的任何物质,其物质的量必相等 | |
| B. | 相同条件下的一氧化碳气体和氮气,若体积相等,则质量也相等 | |
| C. | 不同的气体,若体积不同,则它们所含的分子数也不同 | |
| D. | 在不同条件下,等物质的量的甲烷和一氧化碳所含的分子数一定不等 |
分析 A、阿伏加德罗定律只适用于气体;
B、相同条件下,气体摩尔体积相等,根据m=$\frac{V}{{V}_{m}}$判断;
C、体积不同,不同状态下气体的Vm也不同;
D、根据N=nNA判断.
解答 解:A.阿伏加德罗定律只适用于气体,如不是气体,则不能确定物质的量的关系,故A错误;
B、相同条件下,气体摩尔体积相等,根据m=$\frac{V}{{V}_{m}}$知,相同体积时,其质量之比等于摩尔质量之比,氮气和CO摩尔质量相等,所以其质量相等,故B正确;
C、若体积不同,不同状态下气体的Vm也不同,所以它们所含的分子数也可能相同,故C错误;
D、根据N=nNA知,气体分子数与与物质的量成正比,物质的量相等,则气体分子数相等,故D错误;
故选B.
点评 本题考查了阿伏伽德罗定律及其推论,明确各个公式适用条件是解本题关键,并灵活运用基本公式解答问题,难度中等.

练习册系列答案
相关题目
1.研究氮及其化合物的性质在人类进步过程中具有极为重要的意义.
(1)工业上消除氮的氧化物可采用以下反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H
在温度为T1和T2时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
①温度为T1℃时,0~20min内,v(CH4)=0.0125mol/(L.s).
②T1<T2(填“>”或“<”,下空同);△H<0,判断理由是升高温度,NO2的物质的量增大,平衡逆向移动,正反应为放热反应.
③反应CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)的平衡常数表达式K=$\frac{c({N}_{2})×c(C{O}_{2})×{c}^{2}({H}_{2}O)}{c(C{H}_{4})×{c}^{2}(N{O}_{2})}$,温度为T1℃时,K的值为6.4.
④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将减小(填“增大”、“减小”或“不变”).
(2)已知反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.将一定量N2O4气体充入如图绝热容器一段时间后,压缩和拉伸活塞过程中气体的透光率(气体颜色越浅,透光率越大)随时间变化如图所示.
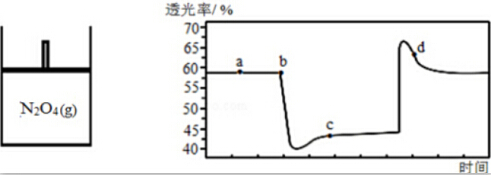
①a点与c点相比,c (NO2)更大的是c,体系温度更低的是a.
②d点,v正(NO2)>v逆(NO2)(填“>”、“<”或“=”).
③下列说法能说明透光率不再发生改变的有ad.
a.气体颜色不再改变 b.△H不再改变
c.v正(N2O4)=2v逆(NO2) d.N2O4的转化率不再改变.
(1)工业上消除氮的氧化物可采用以下反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H
在温度为T1和T2时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
温度/℃ 时间/min | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
②T1<T2(填“>”或“<”,下空同);△H<0,判断理由是升高温度,NO2的物质的量增大,平衡逆向移动,正反应为放热反应.
③反应CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)的平衡常数表达式K=$\frac{c({N}_{2})×c(C{O}_{2})×{c}^{2}({H}_{2}O)}{c(C{H}_{4})×{c}^{2}(N{O}_{2})}$,温度为T1℃时,K的值为6.4.
④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将减小(填“增大”、“减小”或“不变”).
(2)已知反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.将一定量N2O4气体充入如图绝热容器一段时间后,压缩和拉伸活塞过程中气体的透光率(气体颜色越浅,透光率越大)随时间变化如图所示.

①a点与c点相比,c (NO2)更大的是c,体系温度更低的是a.
②d点,v正(NO2)>v逆(NO2)(填“>”、“<”或“=”).
③下列说法能说明透光率不再发生改变的有ad.
a.气体颜色不再改变 b.△H不再改变
c.v正(N2O4)=2v逆(NO2) d.N2O4的转化率不再改变.
2.下表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题.
(1)非金属性最强的元素是F;
(2)Ne原子结构示意图为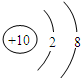 ;
;
(3)N和O中,原子半径较小的是O; (4)H2S和HCl中,热稳定性较强的是HCl;
(5)MgO和Al2O3中,属于两性氧化物的是Al2O3;
(6)元素最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式);
(7)SiO2常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(8)誉称为“绿色氧化剂”的过氧化氢,它的化学式是H2O2,其中氢元素与氧元素的质量比为m(H):m(O)=1:16;(相对原子质量:H-1,O-16)
(9)镁是制造汽车、飞机、火箭的重要材料.写出工业上电解熔融氯化镁获得金属镁的化学方程式:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | N | O | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)Ne原子结构示意图为
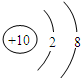 ;
;(3)N和O中,原子半径较小的是O; (4)H2S和HCl中,热稳定性较强的是HCl;
(5)MgO和Al2O3中,属于两性氧化物的是Al2O3;
(6)元素最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式);
(7)SiO2常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(8)誉称为“绿色氧化剂”的过氧化氢,它的化学式是H2O2,其中氢元素与氧元素的质量比为m(H):m(O)=1:16;(相对原子质量:H-1,O-16)
(9)镁是制造汽车、飞机、火箭的重要材料.写出工业上电解熔融氯化镁获得金属镁的化学方程式:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2.
6.元素${\;}_{8}^{18}$O的原子核内中子数与质子数之差为( )
| A. | 8 | B. | 10 | C. | 2 | D. | 18 |
1.把3molP和2.5molQ置于2L密闭容器中,发生如下反应:3P(g)+Q(g)?$\frac{1}{2}$xM(g)+2N(g),5min后达到平衡,生成N1mol,经测定M的平均速率是0.1mol/(L•min),下列叙述错误的是( )
| A. | P的平均反应速率是0.15mol/(L•min) | B. | Q的转化率是25% | ||
| C. | Q的平衡浓度是1mol/L | D. | x的值为2 |