19.下列说法或表示方法正确的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol可知,若将1mol CH3COOH的稀溶液与含1mol NaOH的稀溶液混合,放出的热量小于57.3kJ | |
| C. | 由C(石墨)═C(金刚石))△H=+1.90/mol可知,金刚石比石墨稳定 | |
| D. | 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ/mol |
18.化学与生活密切相关,下列说法不正确的是( )
| A. | 二氧化硫可广泛用于食品的增白 | |
| B. | 聚乙烯塑料制品可用于食品的包装 | |
| C. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| D. | 氧化铝是冶炼金属铝的原料,也是一种较好的耐火材料 |
17.A和B两种有机物可以互溶,有关性质如下:
(1)要除去A和B的混合物中的少量A,可采用A方法即可得到B.
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
(2)若B的分子式为C2H6O,核磁共振氢谱表明其分子中有三种化学环境不同的氯原子,强度之比为3:2:1.则B的结构简式为CH3CH2OH.
(3)若质谱图显示A的相对分子质量为74,红外光谱如图所示,则A的结构简式为CH3CH2OCH2CH3.
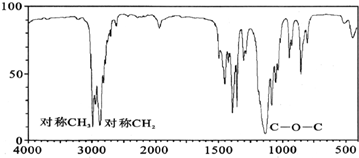
(4)准确称取一定质量的A和B的混合物,在足量氧气中充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增重14.4g和26.4g.计算混合物中A和B的物质的量之比1:1.
| 相对密度(20℃) | 熔点 | 沸点 | 溶解性 | |
| A | 0.7137 | -116.6°C | 34.5°C | 不溶于水 |
| B | 0.7893 | -117.3°C | 78.5°C | 与水以任意比混溶 |
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
(2)若B的分子式为C2H6O,核磁共振氢谱表明其分子中有三种化学环境不同的氯原子,强度之比为3:2:1.则B的结构简式为CH3CH2OH.
(3)若质谱图显示A的相对分子质量为74,红外光谱如图所示,则A的结构简式为CH3CH2OCH2CH3.

(4)准确称取一定质量的A和B的混合物,在足量氧气中充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增重14.4g和26.4g.计算混合物中A和B的物质的量之比1:1.
16.某烃不与溴水反应,能使酸性高锰酸钾溶液褪色,在Fe存在下与Cl2反应,能生成两种一氯代物,该烃是( )
| A. | CH≡C-CH3 | B. | 对二甲苯 | C. | 对甲乙苯 | D. | 邻甲乙苯 |
15.下列描述中正确的是( )
| A. | 强酸与强碱反应都是放热反应 | |
| B. | 氧化还原反应一定都是放热反应 | |
| C. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| D. | 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
12.某化学兴趣小组同学以TiO2和CCl4为原料在实验室制取液态TiCl4,装置如图所示.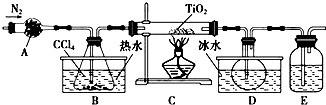
有关信息如下:
①反应原理:TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g)
②反应条件:无水无氧且加热
③有关物质性质如表:
请回答下列问题:
(1)B中盛有CCl4的仪器名称是锥形瓶,仪器A装的试剂不可能是(填序号)b.
a.碱石灰 b.无水硫酸铜 c.氧化钙 d.烧碱
(2)实验开始前的操作包括:①组装仪器,②检查装置气密性,③加装药品,④通一会儿氮气,⑤最后点燃酒精灯.第④步的目的是排除装置中的空气,保证反应在无水、无氧环境下进行.
(3)装置E中的试剂是浓硫酸;E装置不能(填“能”或“不能”)换成A装置,理由是A装置可以吸收水,但不能不能吸收空气中的氧气,不能保证反应在无氧环境下进,故E装置不能换成A装置.
(4)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(5)TiCl4还可由TiO2和焦炭、氯气在加热下反应制得,同时有气体生成,请设计实验方案探究气体的成分.此气体可能是CO或CO2或CO与CO2的混合气体,将气体先通过澄清石灰水,干燥后再通入到灼热的装有CuO的玻璃管中,若不变浑浊则为CO,若浑浊但没有红色固体产生,则为CO2,若浑浊且有红色固体产生,则为CO与CO2的混合气体.

有关信息如下:
①反应原理:TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g)
②反应条件:无水无氧且加热
③有关物质性质如表:
| 物质 | 溶点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)B中盛有CCl4的仪器名称是锥形瓶,仪器A装的试剂不可能是(填序号)b.
a.碱石灰 b.无水硫酸铜 c.氧化钙 d.烧碱
(2)实验开始前的操作包括:①组装仪器,②检查装置气密性,③加装药品,④通一会儿氮气,⑤最后点燃酒精灯.第④步的目的是排除装置中的空气,保证反应在无水、无氧环境下进行.
(3)装置E中的试剂是浓硫酸;E装置不能(填“能”或“不能”)换成A装置,理由是A装置可以吸收水,但不能不能吸收空气中的氧气,不能保证反应在无氧环境下进,故E装置不能换成A装置.
(4)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(5)TiCl4还可由TiO2和焦炭、氯气在加热下反应制得,同时有气体生成,请设计实验方案探究气体的成分.此气体可能是CO或CO2或CO与CO2的混合气体,将气体先通过澄清石灰水,干燥后再通入到灼热的装有CuO的玻璃管中,若不变浑浊则为CO,若浑浊但没有红色固体产生,则为CO2,若浑浊且有红色固体产生,则为CO与CO2的混合气体.
10.(1)已知25℃时有关弱酸的电离平衡常数: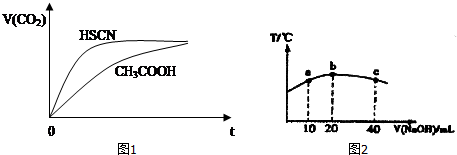
125℃时,将20mL0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20mL 0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示:
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:因为Ka(HSCN)>Ka(CH3COOH),溶液中c(H+)为HSCN>CH3COOH,c(H+)大反应速率快.
反应结束后所得两溶液中,c(SCN-)>c(CH3COO-)(填“>”、“<”或“=”)
②若保持温度不变,下列量会变小的是b(填序号).
a.c(CH3COO-) b.c(H+) c.Kwd.醋酸电离平衡常数.
(2)若往20mL0.1mol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如如图2所示,下列有关说法正确的是②③.
①该烧碱溶液的浓度为0.02mol•L-1
②该烧碱溶液的浓度为0.01mol•L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
0 173647 173655 173661 173665 173671 173673 173677 173683 173685 173691 173697 173701 173703 173707 173713 173715 173721 173725 173727 173731 173733 173737 173739 173741 173742 173743 173745 173746 173747 173749 173751 173755 173757 173761 173763 173767 173773 173775 173781 173785 173787 173791 173797 173803 173805 173811 173815 173817 173823 173827 173833 173841 203614

| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:因为Ka(HSCN)>Ka(CH3COOH),溶液中c(H+)为HSCN>CH3COOH,c(H+)大反应速率快.
反应结束后所得两溶液中,c(SCN-)>c(CH3COO-)(填“>”、“<”或“=”)
②若保持温度不变,下列量会变小的是b(填序号).
a.c(CH3COO-) b.c(H+) c.Kwd.醋酸电离平衡常数.
(2)若往20mL0.1mol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如如图2所示,下列有关说法正确的是②③.
①该烧碱溶液的浓度为0.02mol•L-1
②该烧碱溶液的浓度为0.01mol•L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
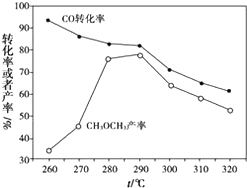 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2,CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下二个反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2,CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下二个反应: