题目内容
10.(1)已知25℃时有关弱酸的电离平衡常数: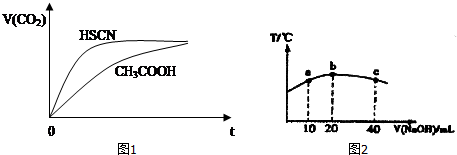
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:因为Ka(HSCN)>Ka(CH3COOH),溶液中c(H+)为HSCN>CH3COOH,c(H+)大反应速率快.
反应结束后所得两溶液中,c(SCN-)>c(CH3COO-)(填“>”、“<”或“=”)
②若保持温度不变,下列量会变小的是b(填序号).
a.c(CH3COO-) b.c(H+) c.Kwd.醋酸电离平衡常数.
(2)若往20mL0.1mol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如如图2所示,下列有关说法正确的是②③.
①该烧碱溶液的浓度为0.02mol•L-1
②该烧碱溶液的浓度为0.01mol•L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
分析 (1)①等浓度的酸的强弱不同,则c(H+)不同,c(H+)越大,反应速率越大;由图象可知反应生成的二氧化碳相同,则消耗的碳酸氢钠相同,反应后应分别为CH3COONa、NaSCN,结合水解程度和电荷守恒判断;
②温度不变,水的离子积常数、醋酸的电离平衡常数不变,在醋酸溶液中加入一定量氨气,一水合氨电离出的氢氧根离子和氢离子反应生成水,促进醋酸电离;
(2)①②HNO2是弱酸,次氯酸电离是吸热反应,酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,据此确定c(NaOH);
③电离吸热,温度越高电离平衡常数越大;
④当c(NaOH)较大时,可能出现:c(Na+)>c(OH-)>c(NO2-)>c(H+).
解答 解:(1)①等浓度的酸的强弱不同,则c(H+)不同,c(H+)越大,反应速率越大,因Ka(HSCN)>Ka(CH3COOH),溶液中c(H+):HSCN>CH3COOH,c(H+)大反应速率快;由图象可知反应生成的二氧化碳相同,则消耗的碳酸氢钠相同,反应后应分别为CH3COONa、NaSCN,因Ka(HSCN)>Ka(CH3COOH),则CH3COONa水解程度较低,则溶液中c(CH3COO-)较小,
故答案为:因为Ka(HSCN)>Ka(CH3COOH),溶液中c(H+)为HSCN>CH3COOH,c(H+)大反应速率快;>;
②a、若保持温度不变,在醋酸溶液中加入一定量氨气,NH3+H2O?NH3.H2O?NH4++OH-,a.OH-+H+=H2O,所以促进醋酸电离,则c(CH3COO-)增大,故a错误;
b.OH-+H+=H2O,所以c(H+)减小,故b正确;
c.温度不变则Kw不变,故c错误;
d.温度不变,则醋酸电离平衡常数不变,故d错误;
故答案为:b;
(2)①HNO2是弱酸,次氯酸电离是吸热反应,酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,c(NaOH)=$\frac{0.020L×0.01mol/L}{0.020L}$=0.01mol/L;
故①错误,②正确;
③电离吸热,温度越高电离平衡常数越大,所以HNO2的电离平衡常数:b点>a点,故③正确;
④从b点到c点,当C(NaOH)较大时,可能出现:c(Na+)>c(OH-)>c(NO2-)>c(H+),故错误;
故答案为:②③.
点评 本题综合考查学生有关热化学、化学反应速率和平衡的有关计算等知识,综合性较强,难度大.

| 实验 序号 | t/min c/(mol•L-1) 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.50 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1中,反应在10-20min内A平均速率为0.013mol/(L•min).
(2)在实验2中,A的初始浓度为c2=1.0mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是使用催化剂.
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3>v1(填“>”、“=”或“<”),且c3>1.0mol/L(填“>”、“=”或“<”).
(4)比较实验4和实验1,通过计算说明温度对反应速率的影响温度越高反应速率越快.
| A. | 强酸与强碱反应都是放热反应 | |
| B. | 氧化还原反应一定都是放热反应 | |
| C. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| D. | 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
| A. | NaHS溶液的水解方程式:HS-+H2O?H3O++S2- | |
| B. | 200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| C. | 向KAl(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
| A. | 常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸反应 | |
| B. | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色,说明浓氨水呈碱性 | |
| C. | H2S能与CuSO4溶液反应生成H2SO4,说明氢硫酸的酸性比硫酸强 | |
| D. | 向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,说明BaCl2有酸性 |