题目内容
15.下列描述中正确的是( )| A. | 强酸与强碱反应都是放热反应 | |
| B. | 氧化还原反应一定都是放热反应 | |
| C. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| D. | 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
分析 A、酸碱中和反应为放热反应;
B、氧化还原反应不一定是放热反应;
C、反应速率与反应是吸热还是放热无关;
D、反应的△H取决于反应物和生成物的总能量的相对大小.
解答 解:A、酸碱中和时要放出热量,故酸碱中和反应均为放热反应,故A正确;
B、氧化还原反应不一定是放热反应,放热反应也不一定是氧化还原反应,故B错误;
C、反应速率与反应是吸热还是放热无关,反应速率与反应物本身的性质及外界条件有关,故C错误;
D、反应的△H取决于反应物和生成物的总能量的相对大小,与反应条件无关,故此反应无论是在光照还是在点燃条件下,反应的热效应不变,故D错误.
故选A.
点评 本题考查反应热与能量变化,题目难度不大,注意能量的表现形式以及常见吸热反应、放热反应.

练习册系列答案
相关题目
3.下列各组离子一定能大量共存的是( )
| A. | 常温下,pH=12的溶液中:SO32-、Cl-、K+、SiO32- | |
| B. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、I- | |
| C. | 在pH=1的溶液中:K+、Fe2+、Cl-、NO3- | |
| D. | 在无色透明溶液中:NH${\;}_{4}^{+}$、Fe3+、SO42-、HCO${\;}_{3}^{-}$ |
10.(1)已知25℃时有关弱酸的电离平衡常数: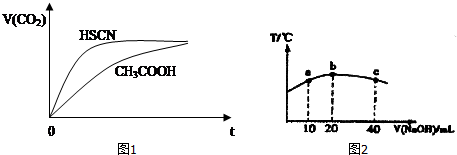
125℃时,将20mL0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20mL 0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示:
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:因为Ka(HSCN)>Ka(CH3COOH),溶液中c(H+)为HSCN>CH3COOH,c(H+)大反应速率快.
反应结束后所得两溶液中,c(SCN-)>c(CH3COO-)(填“>”、“<”或“=”)
②若保持温度不变,下列量会变小的是b(填序号).
a.c(CH3COO-) b.c(H+) c.Kwd.醋酸电离平衡常数.
(2)若往20mL0.1mol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如如图2所示,下列有关说法正确的是②③.
①该烧碱溶液的浓度为0.02mol•L-1
②该烧碱溶液的浓度为0.01mol•L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)

| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:因为Ka(HSCN)>Ka(CH3COOH),溶液中c(H+)为HSCN>CH3COOH,c(H+)大反应速率快.
反应结束后所得两溶液中,c(SCN-)>c(CH3COO-)(填“>”、“<”或“=”)
②若保持温度不变,下列量会变小的是b(填序号).
a.c(CH3COO-) b.c(H+) c.Kwd.醋酸电离平衡常数.
(2)若往20mL0.1mol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如如图2所示,下列有关说法正确的是②③.
①该烧碱溶液的浓度为0.02mol•L-1
②该烧碱溶液的浓度为0.01mol•L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
7.下列各组离子在指定溶液中能大量共存的是( )
| A. | 饱和氯水中:Cl?、NO${\;}_{3}^{-}$、Na+、SO${\;}_{3}^{2-}$ | |
| B. | Na2S溶液中:SO42-、K+、Cl?、Cu2+ | |
| C. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| D. | FeCl3溶液中:K+、NH4+、I-、SCN- |
4.采用不同的分类方法,可将金属氧化物分为不同的类别.例如,从某种意义上讲,可将Na2O、CuO、MgO、Fe2O3等归为一类,则下列氧化物中与它们同属一类的是( )
| A. | Mn2O7 | B. | Na2O2 | C. | Al2O3 | D. | CaO |
5.下列有关物质结构的表述正确的是( )
| A. | 次氯酸的电子式 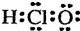 | B. | 钠离子的结构示意图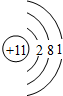 | ||
| C. | 硫原子的最外层电子排布式3s23p4 | D. | 二氧化硅的分子式 SiO2 |
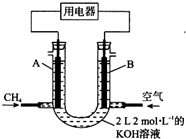 据报道,在青藏高原冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4?nH2O).
据报道,在青藏高原冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4?nH2O).