题目内容
18.化学与生活密切相关,下列说法不正确的是( )| A. | 二氧化硫可广泛用于食品的增白 | |
| B. | 聚乙烯塑料制品可用于食品的包装 | |
| C. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| D. | 氧化铝是冶炼金属铝的原料,也是一种较好的耐火材料 |
分析 A.二氧化硫有毒;
B.聚乙烯塑料无毒;
C.次氯酸具有强的氧化性,能够杀菌消毒;
D.电解氧化铝得到金属铝,氧化铝熔点高;
解答 解:A.二氧化硫有毒,不能够用来漂白食品,故A错误;
B.聚乙烯塑料无毒,可以用来包装食品,故B正确;
C.次氯酸具有强的氧化性,能够杀菌消毒,可用于环境的消毒杀菌,故C正确;
D.电解氧化铝得到金属铝,氧化铝熔点高,氧化铝是冶炼金属铝的原料,也是一种比较好的耐火材料,故D正确;
故选:A.
点评 本题考查了元素化合物知识,熟悉二氧化硫、聚乙烯塑料、次氯酸、氧化铝的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
9.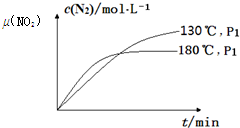 CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
(1)开展实验1和实验2的目的是研究温度对该化学平衡的影响.
(2)180℃时,反应到40min,体系是(填“是”或“否”)达到平衡状态,理由是温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态.可确定40min时反应已经达平衡状态;CH4的平衡转化率为70%.
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值.(写出计算过程)
(4)一定条件下,反应时间t与转化率μ(NO2)的关系如图所示,请在图象中画出180℃时,压强为P2(设压强P2>P1)的变化曲线,并做必要的标注.
 CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:| 实验编号 | 温度 | 0 | 10 | 20 | 40 | 50 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
(2)180℃时,反应到40min,体系是(填“是”或“否”)达到平衡状态,理由是温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态.可确定40min时反应已经达平衡状态;CH4的平衡转化率为70%.
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值.(写出计算过程)
(4)一定条件下,反应时间t与转化率μ(NO2)的关系如图所示,请在图象中画出180℃时,压强为P2(设压强P2>P1)的变化曲线,并做必要的标注.
7.设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 7.8g 苯中含有的单键数目为0.9NA | |
| B. | 1 mol Cl2溶于水,与水反应时电子转移数目为1 NA | |
| C. | 在298K 1.01×105pa下,22 g CO2和N2O混合气体中,所占的体积大于11.2升 | |
| D. | 常温下,pH=13的NaOH溶液中含有的OH-离子数目为0.1NA |
8.X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如表:
(1)Y的元素符号是SS.
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.
(3)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y.此反应的化学方程式是2CO+SO2=S+2CO2.
(5)请设计一个实验方案,比较Y、Z单质氧化性的强弱:在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.
(3)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y.此反应的化学方程式是2CO+SO2=S+2CO2.
(5)请设计一个实验方案,比较Y、Z单质氧化性的强弱:在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.


 某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,组装了如图装置简图:
某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,组装了如图装置简图: