3.工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)?2NH3(g).
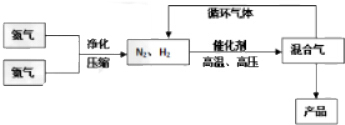
Ⅰ、其部分工艺流程如右图所示,反应体系中各组分的部分性质见下表:
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$.随着温度的升高,K值减小(填增大、减小、不变).平衡常数K值越大,表明AB(填序号).
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(2)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程.即反应后通过把混合气体的温度降低到-33.42使NH3分离出来;继续循环的气体是N2、H2.
Ⅱ、在一密闭容器中发生该反应,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
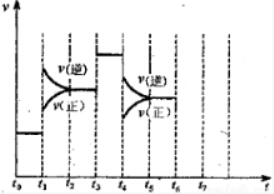
(3)t1、t3、t4时刻分别改变的一个条件是:t1时刻C;t3时刻E;t4时刻B(填选项).
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
(4)依据(2)中的结论,下列时间段中,氨的百分含量最高的是A(填选项).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6.
Ⅰ、其部分工艺流程如右图所示,反应体系中各组分的部分性质见下表:

| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210 | -253 | -78 |
| 沸点(℃) | -195 | -259 | -33 |
(1)写出该反应的化学平衡常数表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$.随着温度的升高,K值减小(填增大、减小、不变).平衡常数K值越大,表明AB(填序号).
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(2)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程.即反应后通过把混合气体的温度降低到-33.42使NH3分离出来;继续循环的气体是N2、H2.
Ⅱ、在一密闭容器中发生该反应,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:

(3)t1、t3、t4时刻分别改变的一个条件是:t1时刻C;t3时刻E;t4时刻B(填选项).
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
(4)依据(2)中的结论,下列时间段中,氨的百分含量最高的是A(填选项).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6.
1.某温度下在恒容密闭容器中发生如下反应:2M(g)+N(g)?2E(g),若开始只充入2molE,达到平衡时,混合气体的压强比起始增加了20%;若开始只充入2molM和1molN,相同温度下欲使平衡时各成分的百分含量与前者相同,则M的转化率为( )
0 173506 173514 173520 173524 173530 173532 173536 173542 173544 173550 173556 173560 173562 173566 173572 173574 173580 173584 173586 173590 173592 173596 173598 173600 173601 173602 173604 173605 173606 173608 173610 173614 173616 173620 173622 173626 173632 173634 173640 173644 173646 173650 173656 173662 173664 173670 173674 173676 173682 173686 173692 173700 203614
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
 如图,一密闭气缸被一不漏气可滑动的活塞隔成两部分,左室充有氮气,右室充有混合气体.在室温下将右室的气体点燃,反应后冷却至原室温,活塞最终静止于气缸的某一点(液体体积忽略不计).
如图,一密闭气缸被一不漏气可滑动的活塞隔成两部分,左室充有氮气,右室充有混合气体.在室温下将右室的气体点燃,反应后冷却至原室温,活塞最终静止于气缸的某一点(液体体积忽略不计).