题目内容
4. 如图,一密闭气缸被一不漏气可滑动的活塞隔成两部分,左室充有氮气,右室充有混合气体.在室温下将右室的气体点燃,反应后冷却至原室温,活塞最终静止于气缸的某一点(液体体积忽略不计).
如图,一密闭气缸被一不漏气可滑动的活塞隔成两部分,左室充有氮气,右室充有混合气体.在室温下将右室的气体点燃,反应后冷却至原室温,活塞最终静止于气缸的某一点(液体体积忽略不计).(1)若右室反应前充有H2和Cl2,点燃后恰好完全反应生成HCl气体,冷却至原室温,活塞最终静止于气缸1处;(填“1”、“2”、“3”、“4”或者“0-1”、“1-2”、“2-3”、“3-4”)
(2)若右室反应前充有H2和O2(H2和O2的物质的量比为2:1),点燃后完全反应,冷却至原室温,活塞最终静止于气缸4处;
(3)若右室反应前充有H2和O2,点燃后完全反应,冷却至原室温,活塞最终静止于气缸的“2”处,则原来H2和O2的物质的量之比可能是多少?(请写出解题过程)
分析 (1)左室中氮气的物质的量不变,令开始氮气的物质的量为1mol,左右两室压强相同,体积之比等于物质的量之比,则由图反应前混合气体的总物质的量为3mol,而氢气和氯气反应的方程式可知:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,可知反应前后气体的物质的量不变;
(2)由反应方程式可知:2H2+O2=2H2O,而 H2和O2的物质的量比为2:1,所以两者恰好完全反应室温下生成液态水,所以右边的气体体积为0,由此分析解答;(3)若右室反应前充有H2和O2,点燃后完全反应,冷却至原室温,活塞最终静止于气缸的“2”处,说明右混合气体反应后剩余1mol,气体的物质的量减少3mol-1mol=2mol,根据差量法计算,原混合气体中氢气、氧气的物质的量,进而计算体积比.
解答 解:(1)左室中氮气的物质的量不变,令开始氮气的物质的量为1mol,左右两室压强相同,体积之比等于物质的量之比,则由图反应前混合气体的总物质的量为3mol,而氢气和氯气反应的方程式可知:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,可知反应前后气体的物质的量不变,所以活塞最终静止于气缸1处,故答案为:1;
(2)由反应方程式可知:2H2+O2=2H2O,而 H2和O2的物质的量比为2:1,所以两者恰好完全反应室温下生成液态水,所以右边的气体体积为0,所以活塞最终静止于气缸4处,故答案为:4;
(3)2H2 +O2=2H2O 气体物质的量减少△n
2 1 3
$\frac{4}{3}$ml $\frac{2}{3}$mol 3mol-1mol=2mol
若剩余气体为氢气,则原混合气体中氧气为$\frac{2}{3}$mol,则氢气为3mol-$\frac{2}{3}$mol=$\frac{7}{3}$mol,H2和O2的体积比为$\frac{7}{3}$mol:$\frac{2}{3}$mol=7:2,
若剩余气体是氧气,则原混合气体中氢气为$\frac{4}{3}$mol,则氢气为3mol-$\frac{4}{3}$mol=$\frac{5}{3}$mol,H2和O2的体积比为$\frac{4}{3}$mol:$\frac{5}{3}$mol=4:5,
答:原来H2和O2的物质的量之比可能是4:5和7:2.
点评 本题考查化学计算、阿伏伽德罗定律等,难度中等,根据左室氮气的物质的量利用体积判断右室气体的物质的量是关键.

 巧学巧练系列答案
巧学巧练系列答案①Fe2(SO4)3Fe2(SO4)3═2Fe3++3SO42-;②NaHSO4NaHSO4═Na++H++SO42-;③KMnO4KMnO4═K++MnO4-.
| A. | -3 | B. | +4 | C. | +3 | D. | +2 |
| A. | H+、Cl-、Cu2+、Ba2+ | B. | OH-、NO${\;}_{3}^{-}$、Ba2+、Cl- | ||
| C. | H+、CO${\;}_{3}^{2-}$、Mg2+、Ba2+ | D. | OH-、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$、Mg2+ |
实验Ⅰ制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3
设计制备装置如下(夹持装置略去):
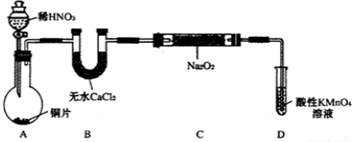
(1)如果没有B装置,C中发生的副反应有2Na2O2+2H2O=4NaOH+O2↑,2NO+O2=2NO2.
(2)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质.于是在A与B装置间增加了在A、B之间增加装有水的洗气瓶装置,改进后提高了NaNO2的纯度.
实验Ⅱ测定制取的样品中NaNO2的含量
步骤:a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:
b.称量0.10g制得的样品溶于水配成500mL溶液.再取5mL待测液,加入1mL M溶液,后加蒸馏水至10mL振荡,与标准色阶比较.
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量.设计并完成下列实验报告.
| 实验方案 | 实验现象 | 实验结论 |
| 取5mL 待测液,加入一定量的维生素C,振荡, 再加入1mL M溶液,加入至蒸馏水10mL,再振荡, 与④号色阶对比. | 紫红色比④色阶浅 | 维生素C 可以有效降低NaNO2的含量. |
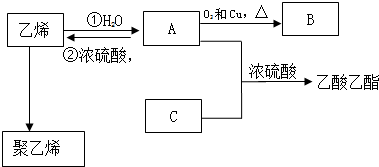
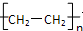 ,化合物C所含官能团的名称为羧基.
,化合物C所含官能团的名称为羧基.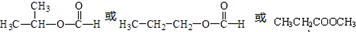 .
.