题目内容
1.某温度下在恒容密闭容器中发生如下反应:2M(g)+N(g)?2E(g),若开始只充入2molE,达到平衡时,混合气体的压强比起始增加了20%;若开始只充入2molM和1molN,相同温度下欲使平衡时各成分的百分含量与前者相同,则M的转化率为( )| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
分析 根据等效平衡,在相同温度下,固定容积的反应容器内,2molE与2molM和1molN的物质的量相当,达到平衡时,两者的平衡状态相同,利用三段式解题方法,可求知结果.
解答 解:设充入2molE达到平衡状态时反应了2xmolE,根据方程式计算如下:
2M(g)+N(g) 2E(g)
2E(g)
起始 0 mol 0 mol 2mol
转化 2x x 2x
平衡 2x x 2-2x
根据阿伏加德罗定律可知相同条件下气体的物质的量之比等于压强之比,则有:$\frac{2x+x+(2-2x)}{2}$=1.2,解得x=0.4mol;
在相同条件下,2molE与2molM和1molN的物质的量相当,达到平衡时,两者的平衡状态相同,即若开始时只充入2molM和1molN的混合气体,
达平衡时M的物质的量为0.8mol,转化的M的物质的量为2mol-0.8mol=1.2mol所以达平衡时M的转化率=$\frac{1.2}{2}$×100%=60%,
故选C.
点评 本题为等效平衡问题,解决这类问题时注意以下两个方面的问题:
(1)对于两边气体分子数不相等的可逆反应,只改变起始时加入物质的物质的量,如果通过可逆反应的化学计量数换算成方程式同一半边的物质时物质的量与起始所给物质对应相同,则两平衡等效.
(2)对于反应前后气体分子数相等的可逆反应,只要反应物(或生成物)的物质的量的比例与起始所给物质的比例对应相同,则两平衡等效.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
2.已知某无色溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是( )
| A. | CO32-、Cl- | B. | Na+、Cu2+ | C. | Mg2+、C1- | D. | C1-、Ba2+ |
10.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2.在该反应中( )
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 当转移8mol电子时,还原产物比氧化产物多1mol |
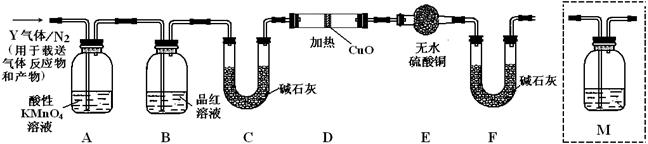 (3)装置B中试剂的作用是检验SO2是否除尽.
(3)装置B中试剂的作用是检验SO2是否除尽.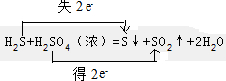 .
.
 H2O2+
H2O2+ 6H+=
6H+= Mn2++
Mn2++ O2↑+
O2↑+ 8H2O;
8H2O;
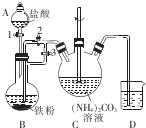 乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,溶于水,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,溶于水,可由乳酸与FeCO3反应制得.