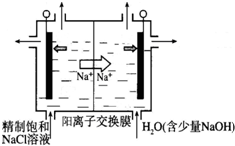
5.海水开发利用的部分过程如图所示.下列说法不正确的是( )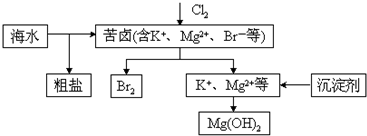

| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 工业生产常选用NaOH作为沉淀剂 | |
| C. | 粗盐可采用除杂和重结晶等过程提纯 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
4.下列说法中,不正确的是( )
| A. | 肉类富含蛋白质,属于碱性食物 | |
| B. | 碳酸氢钠可用于治疗胃酸过多 | |
| C. | 碘是人体必需的微量元素之一 | |
| D. | 食用富含维生素C的水果有益于身体健康 |
2.下列说法不正确的是( )
0 173487 173495 173501 173505 173511 173513 173517 173523 173525 173531 173537 173541 173543 173547 173553 173555 173561 173565 173567 173571 173573 173577 173579 173581 173582 173583 173585 173586 173587 173589 173591 173595 173597 173601 173603 173607 173613 173615 173621 173625 173627 173631 173637 173643 173645 173651 173655 173657 173663 173667 173673 173681 203614
| A. | 刚玉(Al2O3)、金刚砂(SiC)等是耐高温材料 | |
| B. | 氨和二氧化硫易液化,可通过氨水分解吸热,使周围温度降低,可做制冷剂 | |
| C. | 浓硫酸可用于干燥SO2、NO2等气体 | |
| D. | 硅酸钠的水溶液是制备硅胶和木材防火剂的原料 |
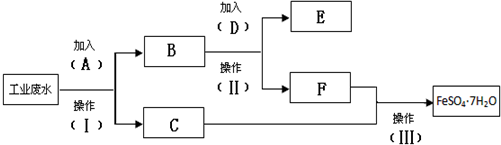
 甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D、E同主族.某同学为探究甲的组成而进行如下实验:
甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D、E同主族.某同学为探究甲的组成而进行如下实验: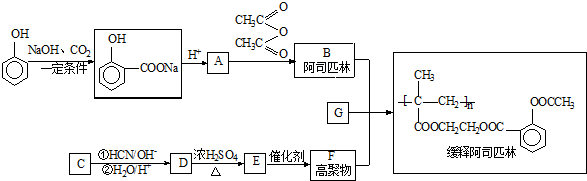

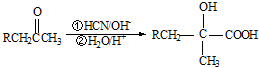
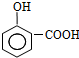 ,写出E→F的反应类型加聚反应.
,写出E→F的反应类型加聚反应.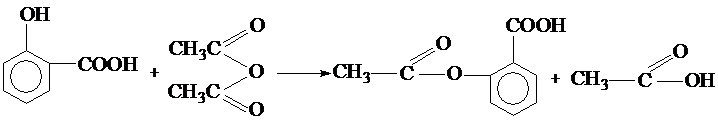 .
.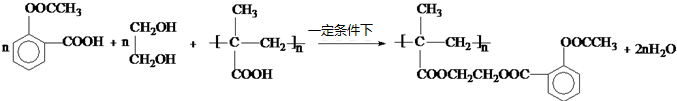 .
. 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.