题目内容
2.下列说法不正确的是( )| A. | 刚玉(Al2O3)、金刚砂(SiC)等是耐高温材料 | |
| B. | 氨和二氧化硫易液化,可通过氨水分解吸热,使周围温度降低,可做制冷剂 | |
| C. | 浓硫酸可用于干燥SO2、NO2等气体 | |
| D. | 硅酸钠的水溶液是制备硅胶和木材防火剂的原料 |
分析 A.氧化铝、碳化硅熔点高;
B.依据铵、二氧化硫沸点高,易液化性质解答;
C.浓硫酸具有吸水性,与二氧化硫、二氧化氮不反应;
D.硅酸钠与酸反应制备硅胶,硅酸钠溶液是矿物胶,不燃烧,阻隔木材与空气中氧气的直接接触.
解答 解:A.氧化铝、碳化硅熔点高,耐高温,故A正确;
B.铵、二氧化硫沸点高,易液化,液态氨气汽化时需要吸收大量的热,常用作制冷剂,故B错误;
C.浓硫酸具有吸水性,与二氧化硫、二氧化氮不反应,可以干燥二氧化硫、二氧化氮,故C正确;
D.硅酸钠与酸反应生成硅酸,可以制备硅胶,硅酸钠溶液是矿物胶,不燃烧,而将硅酸钠涂在木材表面就阻隔了木材与空气中氧气的直接接触,可用作制备木材防火剂的原料,故D正确;
故选:B.
点评 本题考查元素化合物性质及用途,熟悉氧化铝、碳化硅、浓硫酸、硅酸钠的性质是解题关键,注意氨气做制冷剂原理,题目难度不大.

练习册系列答案
相关题目
12.甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用如图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验).
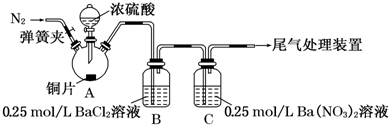
实验操作和现象:
(1)A中反应的化学方程式是Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)C中白色沉淀是BaSO4(化学式).
(3)C溶液中发生的离子方程式为3SO2+3Ba2++2NO3-+2H2O═3BaSO4↓+2NO↑+4H+.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是通N2一段时间,排除装置中的空气
乙在A、B间增加洗气瓶D,D中盛放的试剂是浓硫酸或饱和NaHSO3溶液.
②进行实验,B中现象:
检验白色沉淀,发现均不溶于稀盐酸.用离子方程式解释乙产生少量白色沉淀的原因:2Ba2++2SO2+O2+2H2O═2BaSO4↓+4H+.

实验操作和现象:
| 操 作 | 现 象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C 中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(2)C中白色沉淀是BaSO4(化学式).
(3)C溶液中发生的离子方程式为3SO2+3Ba2++2NO3-+2H2O═3BaSO4↓+2NO↑+4H+.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是通N2一段时间,排除装置中的空气
乙在A、B间增加洗气瓶D,D中盛放的试剂是浓硫酸或饱和NaHSO3溶液.
②进行实验,B中现象:
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
11.在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
| A. | K+ MnO4- Na+ Cl- | B. | K+ Na+ NO3- CO32- | ||
| C. | Na+ H+ NO3- SO42- | D. | Fe3+ Na+ Cl- SO42- |
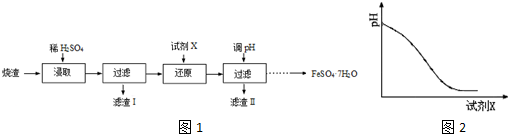
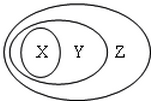 用下图表示的一些物质或概念间的从属关系中不正确的是( )
用下图表示的一些物质或概念间的从属关系中不正确的是( )
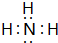 (或
(或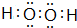
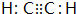 ).
).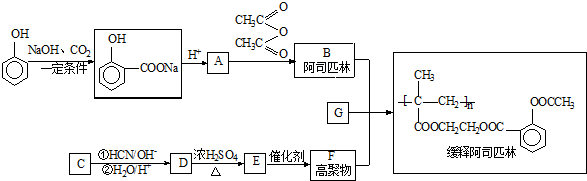

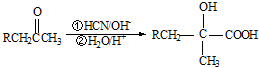
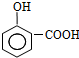 ,写出E→F的反应类型加聚反应.
,写出E→F的反应类型加聚反应.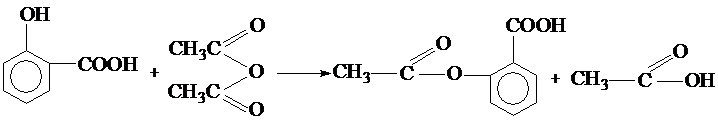 .
.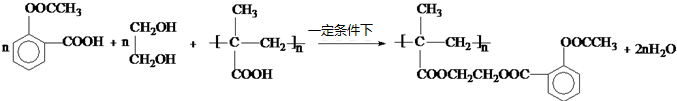 .
. .
.