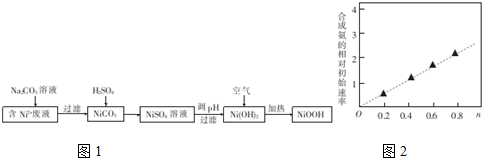
题目内容
20.已知某工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+,为了减少污染并变废为宝,通过如图流程可从该废水中回收FeSO4•7H2O晶体及金属Cu.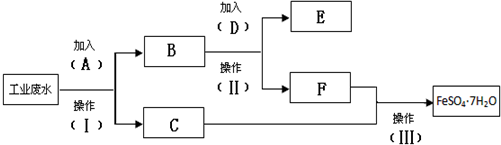
(1)步骤1的主要操作是过滤,发生反应的离子方程式为Fe+Cu2+=Cu+Fe2+.
(2)步骤2中D在化学反应中作氧化剂(选填“氧化剂”或“还原剂”).
(3)步骤3中涉及的操作是:B,过滤,洗涤,烘干.(用字母代号填写)
A.蒸发 B.蒸发浓缩,冷却结晶.
分析 某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+,先加过量铁(A),过滤,得到C溶液为FeSO4,B为Cu和多余的铁,再向B中加过量稀硫酸,过滤得到的E为Cu,F为FeSO4,经蒸发结晶可得到FeSO4•7H2O晶体,
(1)首先除去Cu2+,可加入铁,铁置换出铜;
(2)D为稀硫酸,可与过量的铁反应;
(3)硫酸亚铁溶液经蒸发结晶可得到FeSO4•7H2O晶体.
解答 解:某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+,先加过量铁(A),过滤,得到C溶液为FeSO4,B为Cu和多余的铁,再向B中加过量稀硫酸,过滤得到的E为Cu,F为FeSO4,经蒸发结晶可得到FeSO4•7H2O晶体,
(1)首先除去Cu2+,可加入铁,铁置换出铜,反应的离子方程式为Fe+Cu2+=Cu+Fe2+,过滤后得到溶液和铜,故答案为:过滤;Fe+Cu2+=Cu+Fe2+;
(2)D为稀硫酸,可与过量的铁反应,生成氢气和硫酸亚铁,硫酸为氧化剂,故答案为:氧化剂;
(3)硫酸亚铁溶液经蒸发结晶可得到FeSO4•7H2O晶体,故答案为:B.
点评 本题考查了工艺流程图的分析判断,解答本题要充分理解各种物质的性质,从而得出正确的结论,应熟悉混合物的分离方法,掌握过滤和蒸发结晶分离方法的使用条件及实验操作,题目难度中等.

练习册系列答案
相关题目
8.25℃时,某溶液由H2O电离产生的c(H+)=10-13mol•L-1,则下列离子组在该溶液中一定能大量共存的是( )
| A. | Na+、K+、Cl-、SO42- | B. | Na+、HCO3-、SO42-、Cl- | ||
| C. | Fe2+、K+、SO42-、NO3- | D. | K+、NH4+、SO42-、Cl- |
15.下列指定反应的离子方程式正确的是( )
| A. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32- | |
| B. | 向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O=[Al(OH)4]-+4NH4+ | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ |
5.海水开发利用的部分过程如图所示.下列说法不正确的是( )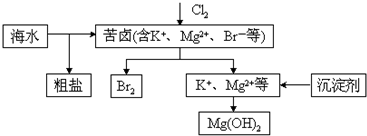

| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 工业生产常选用NaOH作为沉淀剂 | |
| C. | 粗盐可采用除杂和重结晶等过程提纯 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
12.具有下列电子层结构的原子,其对应元素一定属于同一周期的是( )
| A. | 两种原子的电子层上全部都是s电子 | |
| B. | 3p能级上只有一个空轨道的原子和3p能级上有一个未成对电子的原子 | |
| C. | 最外层电子排布式为2s22p6的原子和最外层电子排布式为2s22p6的离子 | |
| D. | 原子核外的M层上的s能级和p能级都填满了电子,而d轨道上尚未排有电子的两种原子 |
9.某雨水样品刚采集时测得pH为4.82,放在烧杯中经2小时后,再次测得pH为4.68.以下叙述正确的是( )
| A. | 雨水样品酸性逐渐减小 | |
| B. | 雨水样品酸性没有变化 | |
| C. | 雨水样品pH降低的原因可能是继续吸收空气中的CO2 | |
| D. | 雨水样品中的pH降低的原因可能是H2SO3逐渐被氧气氧化成H2SO4 |
10.下列有关方程式书写正确的是( )
| A. | NaHCO3的电离:NaHCO3?Na++H++CO32- | |
| B. | HS-的水解:HS-+H2O?H3O++S2- | |
| C. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O (g)△H=-890.3kJ•mol-1 | |
| D. | 双氧水中加入稀硫酸和KI溶液:H2O2+2I-+2H+═I2+2H2O |