13.向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出].乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3时刻为使用催化剂.下列说法中正确的是( )


| A. | 若t1=15 s,用A的浓度变化表示t0~t1阶段的平均反应速率为0.004 mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件一定为减小压强 | |
| C. | 该容器的容积为2 L,B的起始物质的量为0.02 mol | |
| D. | t5~t6阶段,容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式3A(g)?B(g)+2C(g)△H=-50a kJ•mol-1 |
8. 黄曲霉毒素M1是一种具有强致癌性的有机物,其分子结构如图所示.下列有关黄曲霉毒素M1的说法正确的是( )
黄曲霉毒素M1是一种具有强致癌性的有机物,其分子结构如图所示.下列有关黄曲霉毒素M1的说法正确的是( )
 黄曲霉毒素M1是一种具有强致癌性的有机物,其分子结构如图所示.下列有关黄曲霉毒素M1的说法正确的是( )
黄曲霉毒素M1是一种具有强致癌性的有机物,其分子结构如图所示.下列有关黄曲霉毒素M1的说法正确的是( )| A. | 黄曲霉毒素M1的分子式为C17H14O7 | |
| B. | 黄曲霉毒素M1含有羟基,此羟基能被催化氧化为醛基 | |
| C. | 1mol黄曲霉毒素M1与NaOH溶液发生反应最多能消耗2molNaOH | |
| D. | 1mol黄曲霉毒素M1最多能与7molH2发生加成反应 |
7.下列化学用语中表示错误的是( )
| A. | 对硝基苯酚的结构简式: | B. | 甲烷的比例模型: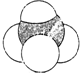 | ||
| C. | 甲基的电子式: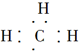 | D. | 葡萄糖的实验式:CH2O |
6.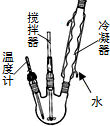 三乙酸甘油酯是一种优良的溶剂、定香剂和增塑剂.实验室制备三乙酸甘油酯的反应原理、实验装置及相关数据如下:3CH3COOH+
三乙酸甘油酯是一种优良的溶剂、定香剂和增塑剂.实验室制备三乙酸甘油酯的反应原理、实验装置及相关数据如下:3CH3COOH+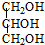 $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$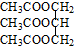 +3H2O
+3H2O
实验步骤:
步骤1.在500mL反应器中加入200g冰醋酸,92g甘油和100mL苯,开动搅拌器,慢慢从插温度计口加入3mL浓硫酸后,缓缓加热并回流1h,停止加热.
步骤2.用5%碳酸钠溶液洗涤,再用水洗涤,最后加入无水氯化钙.
步骤3.先进行常压蒸馏收集75~85℃馏分.
步骤4.将常压馏分再进行减压蒸馏,收集128~131℃/933Pa馏分,最终得产品176g.
(1)步骤1先开搅拌器后加浓硫酸的目的是防止局部浓硫酸浓度过大,造成有机物脱水炭化;冰醋酸过量的目的是有利于向酯化方向移动,提高甘油的转化率
(2)用5%碳酸钠溶液洗涤的主要目的是除去产品的硫酸、乙酸;加无水氯化钙的目的是除去有机物中的水份
(3)最后用减压蒸馏而不用常压蒸馏其原因是防止常压蒸馏温度过高导致产品分解
(4)本次实验产率为80.7%.
0 172855 172863 172869 172873 172879 172881 172885 172891 172893 172899 172905 172909 172911 172915 172921 172923 172929 172933 172935 172939 172941 172945 172947 172949 172950 172951 172953 172954 172955 172957 172959 172963 172965 172969 172971 172975 172981 172983 172989 172993 172995 172999 173005 173011 173013 173019 173023 173025 173031 173035 173041 173049 203614
 三乙酸甘油酯是一种优良的溶剂、定香剂和增塑剂.实验室制备三乙酸甘油酯的反应原理、实验装置及相关数据如下:3CH3COOH+
三乙酸甘油酯是一种优良的溶剂、定香剂和增塑剂.实验室制备三乙酸甘油酯的反应原理、实验装置及相关数据如下:3CH3COOH+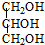 $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$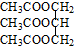 +3H2O
+3H2O| 物质 | 相对 分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中 溶解性 |
| 甘油 | 92 | 1.2636 | 290 (分解) | 溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 三乙酸甘油酯 | 218 | 1.1596 | 258 | 不溶 |
步骤1.在500mL反应器中加入200g冰醋酸,92g甘油和100mL苯,开动搅拌器,慢慢从插温度计口加入3mL浓硫酸后,缓缓加热并回流1h,停止加热.
步骤2.用5%碳酸钠溶液洗涤,再用水洗涤,最后加入无水氯化钙.
步骤3.先进行常压蒸馏收集75~85℃馏分.
步骤4.将常压馏分再进行减压蒸馏,收集128~131℃/933Pa馏分,最终得产品176g.
(1)步骤1先开搅拌器后加浓硫酸的目的是防止局部浓硫酸浓度过大,造成有机物脱水炭化;冰醋酸过量的目的是有利于向酯化方向移动,提高甘油的转化率
(2)用5%碳酸钠溶液洗涤的主要目的是除去产品的硫酸、乙酸;加无水氯化钙的目的是除去有机物中的水份
(3)最后用减压蒸馏而不用常压蒸馏其原因是防止常压蒸馏温度过高导致产品分解
(4)本次实验产率为80.7%.


 .
.