题目内容
8. 黄曲霉毒素M1是一种具有强致癌性的有机物,其分子结构如图所示.下列有关黄曲霉毒素M1的说法正确的是( )
黄曲霉毒素M1是一种具有强致癌性的有机物,其分子结构如图所示.下列有关黄曲霉毒素M1的说法正确的是( )| A. | 黄曲霉毒素M1的分子式为C17H14O7 | |
| B. | 黄曲霉毒素M1含有羟基,此羟基能被催化氧化为醛基 | |
| C. | 1mol黄曲霉毒素M1与NaOH溶液发生反应最多能消耗2molNaOH | |
| D. | 1mol黄曲霉毒素M1最多能与7molH2发生加成反应 |
分析 A.根据结构简式确定分子式;
B.该分子中含有醚键、醇羟基、碳碳双键、羰基和酯基,具有醚、醇、烯烃、酮和酯的性质;
C.黄曲霉毒素M1含有酯基,酯基水解后得到1个酚羟基;
D.苯环和碳碳双键、羰基能与氢气发生加成反应.
解答 解:A.由有机物结构可确定有机物分子式为C17H12O7,故A错误;
B.与羟基相连的C上无H,此羟基不能被氧化,故B错误;
C.黄曲霉毒素M1含有酯基,酯基水解后得到1个酚羟基,故1 mol黄曲霉毒素M1与NaOH溶液发生反应最多能消耗2 mol NaOH,故C正确;
D.黄曲霉素中,能与氢气发生加成反应的有1个苯环、2个碳碳双键和1个羰基,则1mol黄曲霉素可以和6molH2发生加成反应,故D错误,
故选C.
点评 本题考查有机物结构和性质,为高频考点,侧重考查醚、醇、烯烃、酮、酯的性质,明确官能团及其性质关系是解本题关键,易错选项是C,注意含有苯环.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
18.按照物质的树状分类和交叉分类,HNO3应属于( )
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸 ⑥强氧化性酸 ⑦一元酸 ⑧化合物.
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸 ⑥强氧化性酸 ⑦一元酸 ⑧化合物.
| A. | ①②③④⑤⑥⑦⑧ | B. | ①④⑥⑦⑧ | C. | ①⑧ | D. | ①④⑤⑥⑦ |
19.下列关于化学反应分类的说法中,正确的是( )
| A. | 凡是有单质生成的分解反应一定是氧化还原反应 | |
| B. | CO与Fe2O3高温下反应为氧化还原反应,是置换反应 | |
| C. | 天然气的燃烧,不属于置换反应,为非氧化还原反应 | |
| D. | 1828年德国化学家维勒最先完成有机物的制取:NH4CNO$\frac{\underline{\;\;△\;\;}}{\;}$CO(NH2)2,该反应不属于四种反应类型中的任何一种,但属于氧化还原反应 |
16.利用海洋资源获得的部分物质如图所示,有关说法正确的是( )

| A. | 在化学反应中,${\;}_{1}^{1}$H2O可转变为D2O | |
| B. | “加碘食盐”生产中碘添加剂为单质I2 | |
| C. | 实验室用带玻璃塞的棕色瓶贮存液Br2 | |
| D. | 电解饱和MgCl2溶液时在阴极得到Mg |
13.向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出].乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3时刻为使用催化剂.下列说法中正确的是( )


| A. | 若t1=15 s,用A的浓度变化表示t0~t1阶段的平均反应速率为0.004 mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件一定为减小压强 | |
| C. | 该容器的容积为2 L,B的起始物质的量为0.02 mol | |
| D. | t5~t6阶段,容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式3A(g)?B(g)+2C(g)△H=-50a kJ•mol-1 |
20.化学理论在元素单质及其化合物反应中应用广泛.(1)在一定条件下,可逆反应mA?nB+pC△H,达到平衡状态.
①若A、B、C都是气体,增大压强,平衡向正反应方向移动,则m大于n+p(填“大于”、“小于”或“等于”).
②其他条件不变,加热后A的质量减小,则反应△H大于0(填“大于”、“小于”或“等于”).
(2)某些金属氧化物(如FeXOY)粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是c(填序号)

(3)一定温度下,发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H.已知该反应在不同温度下的平衡常数如下表:
请回答下列问题:
①该反应的△H<0(填“>”、“<”或“=”).
②T℃时,将FeO(s)和COg)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为W1,c(CO2)=0.15mol•L-1,则温度T低于(填“高于”、“低于”、“等于”)1000,若此时保持其它条件不变再充入2.0mol CO(g),再达平衡时测得CO转化率为W2,则W1=W2(填“>”、“<”或“=”).
①若A、B、C都是气体,增大压强,平衡向正反应方向移动,则m大于n+p(填“大于”、“小于”或“等于”).
②其他条件不变,加热后A的质量减小,则反应△H大于0(填“大于”、“小于”或“等于”).
(2)某些金属氧化物(如FeXOY)粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是c(填序号)

(3)一定温度下,发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H.已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
①该反应的△H<0(填“>”、“<”或“=”).
②T℃时,将FeO(s)和COg)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为W1,c(CO2)=0.15mol•L-1,则温度T低于(填“高于”、“低于”、“等于”)1000,若此时保持其它条件不变再充入2.0mol CO(g),再达平衡时测得CO转化率为W2,则W1=W2(填“>”、“<”或“=”).
18.现有c(CH3COOH)=0.1mol/L的溶液,能使CH3COOH的电离平衡向右移动且能使c(CH3COO-)增大的是( )
| A. | 加大量水稀释 | B. | 降低温度 | C. | 加少量NaOH | D. | 加少量CH3COONa |
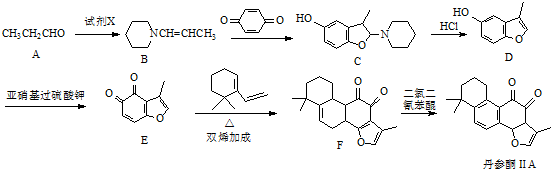
 .
.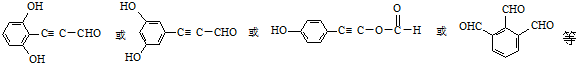 .
.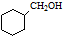 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:CH3CHO$→_{催化剂,△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4},△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:CH3CHO$→_{催化剂,△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4},△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.