18.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(H+)=c(OH-) | |
| B. | 0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH${\;}_{4}^{+}$)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) | |
| D. | 0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O${\;}_{4}^{2-}$)+c(HC2O${\;}_{4}^{-}$)+c(OH-)=c(Na+)+c(H+) |
17.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中: c(Na+)>c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH${\;}_{4}^{+}$)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
14.N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0;一定温度下,向10L恒容密闭容器中通入N2O5,的部分实验数据见下表:下列说法不正确的是( )
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol | 5.00 | 3.5 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为3×10-4mol•(L•s)-1 | |
| B. | 反应达平衡后,往容器中加入5molN2O5气体,平衡正向移动,反应的热效应变大 | |
| C. | 相同温度下,起始时向容器中充入5molNO2和1.25molO2,达到平衡时,NO2的转化率小于50% | |
| D. | 达到平衡后,相同条件下往容器中充入2.5molN2O5和1.25molO2,此时平衡将向右移动 |
13.下列叙述正确的是( )
| A. | 25℃时,0.1mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| B. | 某反应2A(g)?C(g)+3D(g)在高温时能自发进行,则该反应的△H<0 | |
| C. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| D. | 在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫外加电流的阴极保护法 |
12.25℃时进行四组实验,其中“实验内容”与对应“现象或结论”关系错误的是( )
| 选项 | 实验内容 | 现象或结论 |
| A | 向2SO2+O2?2SO3的平衡体系中加入由18O构成的氧气 | 则SO2中的18O的含量会增加 |
| B | 以石墨为电极,电解KI溶液(其中含有少量酚酞) | 阴极逸出气体且附近溶液呈现红色 |
| C | FeCl3+3KSCN?Fe(SCN)3+3KCl 平衡体系中加入少量KSCN固体,溶液颜色加深 | 恒温时增大反应物浓度,平衡向正反应方向移动 |
| D | 向pH=1的盐酸和醋酸各0.5L的溶液中各加入1.4g铁粉 | 醋酸中生成H2的速率快且最终气体量多 |
| A. | A | B. | B | C. | C | D. | D |
11.图表示298K时N2与H2反应过程中的能量变化.根据右图叙述正确的是( )
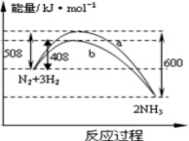

| A. | 该反应的热化学方程式为: $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),△H=-92kJ•mol-1 | |
| B. | 不用催化剂,生成 1molNH3放出的热量为46 KJ | |
| C. | 加入催化剂,生成 1molNH3的反应热减小50 KJ•mol-1 | |
| D. | 在温度体积一定的条件下,通入1molN2和3molH2,反应后放出的热量为Q1,若通入2molN2和6molH2,反应后放出的热量为Q2,则Q1=0.5Q2<92KJ |
10.10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列物质,能减慢反应速率但又不影响氢气生成总量的是( )
0 172790 172798 172804 172808 172814 172816 172820 172826 172828 172834 172840 172844 172846 172850 172856 172858 172864 172868 172870 172874 172876 172880 172882 172884 172885 172886 172888 172889 172890 172892 172894 172898 172900 172904 172906 172910 172916 172918 172924 172928 172930 172934 172940 172946 172948 172954 172958 172960 172966 172970 172976 172984 203614
| A. | 加入少量CuSO4固体 | B. | 加入少量CH3COONa固体 | ||
| C. | 加入少量NH4HSO4固体 | D. | 加入少量Na2CO3固体 |
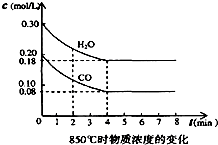 某可逆反应的平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$,恒容时,温度升高H2浓度减小.试回答下列问题:
某可逆反应的平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$,恒容时,温度升高H2浓度减小.试回答下列问题: