题目内容
10.10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列物质,能减慢反应速率但又不影响氢气生成总量的是( )| A. | 加入少量CuSO4固体 | B. | 加入少量CH3COONa固体 | ||
| C. | 加入少量NH4HSO4固体 | D. | 加入少量Na2CO3固体 |
分析 根据反应的实质为Zn+2H+═Zn2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,注意Zn过量,以此来解答.
解答 解:A.Zn可以置换出Cu,构成原电池,加快反应速率,故A错误;
B.加入CH3COONa溶液,溶液被稀释,且醋酸根与溶液中氢离子结合为醋酸分子,溶液中氢离子降低,且提供的氢离子总量不变,故能减慢反应速率且又不影响氢气生成量,故B正确;
C.加入少量NH4HSO4固体,溶液氢离子浓度增大,反应速率增大,故C错误;
D.加入碳酸钠溶液,与盐酸反应是二氧化碳,氢离子总量较小,生成氢气的量减少,故D错误,
故选B.
点评 本题考查化学反应速率影响因素,为高频考点,比较基础,需注意生成氢气的量不变,注意A选项构成原电池,加快反应速率.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
18.下列电离方程式的书写不正确的是( )
| A. | NH3•H2O═NH$\stackrel{+}{4}$+OH- | B. | BaSO4═Ba2++SO$\stackrel{2-}{4}$ | ||
| C. | HNO3═H++NO$\overline{3}$ | D. | NaOH═Na++OH- |
5.六偏磷酸钠(Na6P6O18)常用于食品加工.六偏磷酸钠中磷元素的化合价为( )
| A. | -3 | B. | +2 | C. | +4 | D. | +5 |
19.分类是科学研究的重要方法,下列物质分类不正确的是( )
| A. | 化合物:干冰,冰水混合物,烧碱,小苏打 | |
| B. | 电解质:硫酸,甲烷,烧碱,食盐 | |
| C. | 同素异形体:石墨,C60,C80,金刚石 | |
| D. | 混合物:豆浆,纯净矿泉水,分析纯盐酸,石灰石 |
20.反应C(s)+H2O(g)?CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 保持体积不变,充入N2使体系压强增大 | |
| B. | 将容器的体积缩小一半 | |
| C. | 增H2的量 | |
| D. | 压强不变充入N2使容器体积增大 |
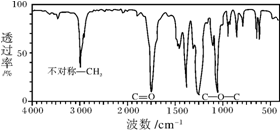 如图是一种分子式为C4H8O2的有机物的红外光谱图,则该有机物的结构简式为CH3COOCH2CH3或是CH3CH2COOCH3(写一种即可),写出其在碱性条件下的水解反应式:CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH.
如图是一种分子式为C4H8O2的有机物的红外光谱图,则该有机物的结构简式为CH3COOCH2CH3或是CH3CH2COOCH3(写一种即可),写出其在碱性条件下的水解反应式:CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH.