17.下列说法不正确的是( )
| A. | 能量的释放或吸收是以发生变化的物质为基础的,二者密不可分,但以物质为主,如果物质没有变化,就不能引发能量的变化 | |
| B. | 氢能的优点是燃烧热值高,资源丰富,无毒无污染,且便于储存和运输,因此很可能成为未来的主要能源 | |
| C. | 对于在给定条件下反应物之间能够同时发生多个反应的情况,理想的催化剂还可以大幅度提高目标产物在最终产物中的比率 | |
| D. | 离子反应的速率决定于溶液中离子的浓度和离子的扩散速率,受温度影响不大,是一类不需要活化能来引发的反应,所以反应速率很高 |
16.某烃的结构简式为: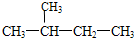 ,它的名称是( )
,它的名称是( )
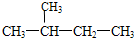 ,它的名称是( )
,它的名称是( )| A. | 3-甲基戊烷 | B. | 2,3-二甲基丙烷 | C. | 2-甲基丁烷 | D. | 3-甲基丁烷 |
15.某烃的结构简式为: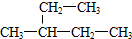 ,它的名称是( )
,它的名称是( )
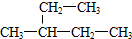 ,它的名称是( )
,它的名称是( )| A. | 3-乙基丁烷 | B. | 3-乙基戊烷 | C. | 2-乙基丁烷 | D. | 3-甲基戊烷 |
14.农药波尔多液可用于水果灭虫,是由石灰水和硫酸铜溶液混合而成的悬浊液.它不能用铁制容器盛放,是因为铁与该农药中的硫酸铜起反应.在该反应中,对铁的叙述错误的是( )
| A. | 铁发生还原反应 | B. | 铁发生氧化反应 | C. | 铁是还原剂 | D. | 铁失去电子 |
13.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则该反应的△H<0(填写“>”、“<”、“=”).
(2)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是CD.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(3)某同学设计了三组实验,实验条件已经填在下面实验设计表中,分析表格我们可以看出该同学的实验目的主要是研究温度和催化剂比表面积对化学反应速率的影响.
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)在上述条件下反应能够自发进行,则该反应的△H<0(填写“>”、“<”、“=”).
(2)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是CD.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(3)某同学设计了三组实验,实验条件已经填在下面实验设计表中,分析表格我们可以看出该同学的实验目的主要是研究温度和催化剂比表面积对化学反应速率的影响.
| 实验编号 | T(℃) | NO初始浓(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
12.NO是一种性质活泼的大气污染物,它能与很多物质发生反应.
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)•c({O}_{2})}$.已知K300°C >K350°C,则该反应是放热反应.
(2)图中表示NO2的变化的曲线是b.用O2表示从0-2 s内该反应的平均速率v=0.0015mol/(L•s).
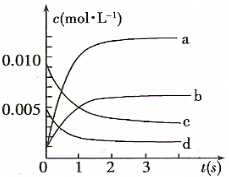
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度d.选择高效催化剂.
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b.用O2表示从0-2 s内该反应的平均速率v=0.0015mol/(L•s).

(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度d.选择高效催化剂.
11.已知下列反应,回答下列问题:
2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol ①
Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-266kJ/mol ②
(1)CO的燃烧热为283kJ/mol.
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:CO(g)+Na2O2(s)=Na2CO3(s)△H=-549kJ/mol.
(3).已知反应①中的相关的化学键键能数据如下:则a=496kJ/mol.
2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol ①
Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-266kJ/mol ②
(1)CO的燃烧热为283kJ/mol.
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:CO(g)+Na2O2(s)=Na2CO3(s)△H=-549kJ/mol.
(3).已知反应①中的相关的化学键键能数据如下:则a=496kJ/mol.
| 化学键 | C=O(CO2) | C O O(CO) | O=O |
| E/(kJ.mol-1) | 803.5 | 1076 | a |
10.下列物质的水溶液中不存在溶质分子的是( )
| A. | H2S | B. | HF | C. | HNO3 | D. | NH3•H2O |
9.下列各组物质,用一种试剂无法区别的是( )
0 172730 172738 172744 172748 172754 172756 172760 172766 172768 172774 172780 172784 172786 172790 172796 172798 172804 172808 172810 172814 172816 172820 172822 172824 172825 172826 172828 172829 172830 172832 172834 172838 172840 172844 172846 172850 172856 172858 172864 172868 172870 172874 172880 172886 172888 172894 172898 172900 172906 172910 172916 172924 203614
| A. | 三种浓酸:HNO3、H2SO4、HCl | |
| B. | 四种黑色粉末:FeO、Fe、CuO、C | |
| C. | 四种无色溶液:NaCl、NaOH、KOH、KCl | |
| D. | 四种白色粉末:(NH4)2SO4、NH4Cl、Na2SO4、NaCl |