题目内容
11.已知下列反应,回答下列问题:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol ①
Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-266kJ/mol ②
(1)CO的燃烧热为283kJ/mol.
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:CO(g)+Na2O2(s)=Na2CO3(s)△H=-549kJ/mol.
(3).已知反应①中的相关的化学键键能数据如下:则a=496kJ/mol.
| 化学键 | C=O(CO2) | C O O(CO) | O=O |
| E/(kJ.mol-1) | 803.5 | 1076 | a |
分析 (1)1mol可燃物完全燃烧生成稳定氧化物时放出热量称为燃烧热,结合热化学方程式计算;
(2)依据盖斯定律结合已知方程式求算;
(3)依据化学反应焓变=反应物键能总和-生成物键能总和计算.
解答 解:(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出热量,已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,一氧化碳的燃烧热为283KJ/mol,
故答案为:283kJ/mol;
(2)已知①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
②Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-266kJ/mol,
由盖斯定律:$\frac{1}{2}$×①+②得CO(g)+Na2O2(s)=Na2CO3(s)△H=$\frac{1}{2}$×(-566)+(-266)=-549 kJ/mol,
故答案为:CO(g)+Na2O2(s)=Na2CO3(s)△H=-549 kJ/mol;
(3)焓变=反应物键能总和-生成物键能总和,则反应①的△H=-566kJ/mol=1076kJ/mol×2+akJ/mol-803.5kJ/mol×2×2,
解得:a=496,
故答案为:496.
点评 本题考查了热化学方程式的书写及计算,题目难度中等,明确盖斯定律的含义为解答关键,注意掌握焓变与反应物、生成物键能的关系,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
1.下列对氧化还原反应的分析中合理的是( )
| A. | Mg变为MgO时化合价升高,因此,Mg在该反应中作还原剂 | |
| B. | KMnO4受热分解时,Mn元素化合价一方面升高一方面降低,因此,在该反应中Mn元 素既被氧化又被还原 | |
| C. | 凡是氧化还原反应都能造福人类 | |
| D. | 在反应2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑中H2O是还原剂 |
2.对于反应COCl2(g)?CO(g)+Cl2(g)△H=-QkJ•mol-1(Q>0)化学平衡常数为K 则下列叙述正确的是
( )
( )
| A. | 一定条件下,该反应在任何温度下均能自发进行 | |
| B. | 反应CO(g)+Cl2(g)?COCl2(g)△H=+Q kJ•mol-1 化学平衡常数为K | |
| C. | 反应2COCl2(g)?2CO(g)+2Cl2(g) 化学平衡常数为2K | |
| D. | 将1mol COCl2 (g)置于一密闭容器中充分反应后放出QkJ的热量 |
19.NA 表示阿伏加德罗常数,则下列说法正确的是( )
| A. | 22.4L CO中一定含有6.02×1023个分子 | |
| B. | 在标准状况下,22.4L CH4与18g H2O所含有的电子数均为10 NA | |
| C. | 常温常压下,16g O2 与16gO3含有的分子数相同 | |
| D. | 0.1 mol/L K2SO4 溶液中含有 K+为0.2 NA |
6.0.5L AlCl3溶液中Cl-为9.03×1022个,则AlCl3溶液的物质的量浓度为( )
| A. | 0.1 mol•L-1 | B. | 1 mol•L-1 | C. | 3 mol•L-1 | D. | 1.5 mol•L-1 |
16.某烃的结构简式为: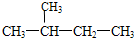 ,它的名称是( )
,它的名称是( )
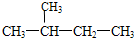 ,它的名称是( )
,它的名称是( )| A. | 3-甲基戊烷 | B. | 2,3-二甲基丙烷 | C. | 2-甲基丁烷 | D. | 3-甲基丁烷 |
20.下列事实不能用勒夏特列原理解释的是( )
| A. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 反应H2(g)+I2(g)?2HI(g) 达到平衡后,压缩容器的体积,体系颜色加深 | |
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 | |
| D. | 增大压强,有利于SO2与O2反应生成SO3 |
1.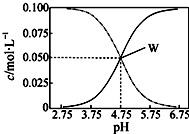 25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )
25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )
 25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )
25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )| A. | pH=5.5溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | W点表示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH) | |
| C. | pH=3.5溶液中:c(Na+)-c(OH-)+c(CH3COOH)=0.1 mol/L | |
| D. | 向W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |